Характеристики субмикронных неоднородностей в водных растворах сахаров. Возможный фактор криопротекции
- Организации
-
- 1. ФИЦ ПНЦБИ РАН
- Опубликован:
- 2025-03-30
- Ключевые слова:
- водные растворы, субмикронные неоднородности, сахара, криопротекция, методы светорассеяния
Аннотация
Настоящая работа посвящена изучению субмикронных неоднородностей (СМН), спонтанно формирующихся в водных растворах низкомолекулярной органики. В растворах четырёх сахаров: глюкозы, сахарозы, мальтозы и трегалозы с концентрациями 0.5 – 1.5 моль% зарегистрировано наличие СМН с размерами около 100 нм. Кроме того, используя комбинированное применение методов динамического светорассеяния, статического многоуглового светорассеяния и теории Ми, определены коэффициенты преломления СМН, которые оказались почти идентичными коэффициентам преломления содержащих их растворов, отличия 0.001 - 0.01. Эти значения аномально малы для обычных коллоидов, что и объясняет малозаметность СМН. Концентрация СМН возрастает с ростом концентрации сахаров. Судя по значениям дифференциальных коэффициентов преломления СМН в разных растворах, состав и структура СМН может сильно отличаться даже для структурно близких молекул, как пример, дисахаридов. При концентрациях сахаров ~10 вес%, типичных для криопротекторных растворов, у раствора трегалозы наблюдается гораздо меньшее значение дифференциального коэффициента преломления СМН и их наибольшая концентрация по сравнению с растворами остальных сахаров. Впервые высказано предположение о роли СМН в процессах криозащиты, что может объяснить наибольшую криопротекторную эффективность трегалозы среди других низкомолекулярных сахаров.
Полный текст
Введение
Множество исследований физического, химического, биологического профилей и ряда смежных дисциплин проводится с образцами в виде водных растворов, так как они являются удобными моделями различных природных систем. По химической классификации растворы делят на два типа, истинные и коллоидные, которые считаются принципиально отличными друг от друга. Истинные растворы однородны, тогда как коллоидные растворы в надмолекулярном масштабе содержат неоднородности состава и плотности. Однако ещё в 1972 г. Вукс и Шурупова обнаружили в типичном истинном растворе вода/трет-бутанол аномальное рассеяние, связанное с наличием неоднородностей, которые авторы интерпретировали как нестабильные клатратоподобные структуры [1]. В дальнейшем многократно было показано, что в этом и многих других растворах, действительно, формируются некие неоднородности, но названия и интерпретации им давались разные [2–7]. Сейчас они обнаружены в более чем 100 различных растворах [8–10], что говорит об универсальности данного явления. В большинстве своём это водные растворы низкомолекулярной органики. Удивительно, но до сих пор все эти растворы считаются истинными.
Дело в том, что обсуждаемые неоднородности в большинстве случаев трудно идентифицировать из-за их очень малого оптического и плотностного контраста относительно среды. Это не позволяет их зарегистрировать общепринятыми методами, такими как малоугловое рентгеновское [11] и нейтронное рассеяние [12]. Наиболее чувствительными оказались методы светорассеяния, а именно динамическое светорассеяние (ДСР) и многоугловое статическое светорассеяние [8, 9, 13–16]. Были попытки показать применимость и других методов: поляриметрия [17], измерение сжимаемости [5], криомикроскопия [18], но они гораздо менее информативны.
Методы светорассеяния показывают, что эти неоднородности имеют размеры от десятков до сотен нанометров, в связи с чем в работах [19–21] они были названы субмикронными неоднородностями (СМН). Кроме измерения размеров СМН, в некоторых работах [15, 19] предлагались методы определения их концентрации и коэффициента преломления.
Несмотря на очевидность факта наличия СMH во многих водных растворах органики и полувековую историю их исследования, природа СМН во многом неясна. По-видимому, СMH представляют собой области раствора с повышенным содержанием органического компонента, ведущие себя как броуновские частицы [22]. Они обладают сферической формой и способны частично пропускать через себя воду [19]. СМН являются стабильными образованиями, по крайней мере в некоторых растворах их стабильность экспериментально подтверждена в течение месяцев [9, 22] и даже лет [23] после приготовления раствора.
Механизмы сохранения стабильности предлагались разные, но общепринятой точки зрения нет. По одной из версий СMH образуются в результате связывания молекул растворённого вещества мостиками водородных связей из молекул воды [10]. По другой версии [15, 24–26] образование СMH объясняется распадом раствора спинодального типа, происходящим под влиянием дихотомического шума перекрёстных мерцающих водородных связей.
В некоторых работах высказано мнение, что формирование СMH в водных растворах возможно только в присутствии гидрофобных компонентов [11,12, 22, 23]. Гидрофобные примеси хотя бы в следовых количествах всегда присутствуют как в природе, так и в реактивах, даже высокой степени чистоты. Также сложно избежать влияния растворённых газов воздуха и пластиковой лабораторной посуды. Согласно одной из гипотез, СМН состоят из обогащённого гидрофобными компонентами ядра, вокруг которого образуется оболочка, с повышенным содержанием органических молекул [14]. Либо образуются мицеллы с размерами около 10 нм, которые затем объединяются в более крупные кластеры [27]. В то же время, наличие гидрофобных компонент в составе СМН противоречит результатам нашей недавней работы [20], свидетельствующей о гидрофильной природе СМН.
Высказывалась также гипотеза, что СMH – это пузырьки воздуха [5, 28, 29], хотя намного больше работ посвящено тому, чтобы эту гипотезу опровергнуть [13, 30–33]. Возможно, наличие пузырьков в водных растворах органики предполагалось по аналогии с водными растворами солей, в которых формируются пузырьки, стабилизированные ионами [34–37]. В нашей работе [19] было показано, что пузырьки субмикронных размеров действительно могут в таких растворах присутствовать, но в очень малых количествах, а в основной массе СМН имеют другую природу. Они тоже сферичны, но имеют гораздо меньшие оптический и плотностный контрасты.
При изучении СMH часто использовали процедуру фильтрации. Обычно это устраняет СMH [11, 13, 38, 39]. В некоторых случаях они образуются вновь [18, 21, 40], а в некоторых нет [21, 22]. Значит фильтрация просто разрушает СMH, а не в прямом смысле фильтрует их. Это даёт удобную возможность проводить сравнительные исследования растворов одинакового химического состава, содержащие и не содержащие СMH.
Среди работ по изучению СMH в водных растворах органики крайне мало публикаций посвящено сахарам. Сахара относятся к одному из четырёх фундаментальных типов биомолекул – углеводам [41], которые играют незаменимую роль во многих биологических процессах, связанных с энергетикой [42], адгезией клеток [43], межклеточным взаимодействием [44], биопротекторными механизмами [45], и др. Все эти процессы изучены далеко не полностью, при этом возможная роль СMH в биологических процессах вообще не рассматривалась.
В настоящей работе методами светорассеяния проведено изучение СМН, формирующихся в водных растворах ряда сахаров при различных концентрациях. Определены интенсивности рассеяния в этих растворах, гидродинамические диаметры СМН и их коэффициенты преломления. Проводится сравнение характеристик СМН в растворах разных сахаров. Впервые обсуждается возможная роль СМН в криопротекции.
Материалы и методы
2.1. Реактивы и приготовление растворов
В работе использовались следующие реактивы: D(+)-глюкоза безводная #131341 (Panreac, Испания), D(+)-сахароза безводная #141621 (Panreac, Испания), D(+)-мальтоза моногидрат #LC-5054.4 (NeoFroxx, Германия), D(+)-трегалоза дигидрат #A1742 (Panreac, Испания) и вода MilliQ (Millipore, Германия). Готовили растворы каждого сахара в концентрациях 0.5, 1 и 1.5 моль% весовым методом. Растворение проводили путём плавного ручного переворачивания пробирки 20 мл (Sarstedt, Германия) до полного визуального растворения при комнатной температуре. Каждый раствор готовили не менее 3 раз.
2.2. Метод ДСР
Метод ДСР, принцип которого широко известен [46], реализовывался с использованием установки Фотокор Комплекс (ООО «Фотокор», Россия). Измерения интенсивности рассеяния в растворах лазерного излучения с длиной волны λ =451 нм мощностью 50 мВт производились под углом θ=140˚ градусов. В качестве детектора использовался лавинный фотодиод, работающий в режиме счёта фотонов, поэтому интенсивность измерялась в кГц (тысячи отсчётов в секунду).
Кроме измерения среднего значения интенсивности рассеяния, измерялись временные флуктуации интенсивности, из которых определялась автокорреляционная функция G2(τ), которая в случае монодисперсных броуновских частиц связана с их коэффициентом диффузии D следующим образом:
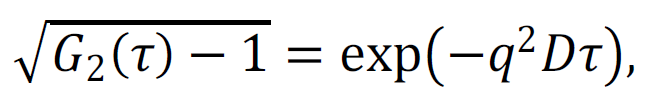 |
(1) |
где τ – время корреляции, а q – модуль вектора рассеяния:
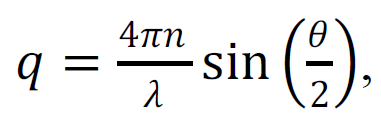 |
(2) |
n – коэффициент преломления раствора. Из соотношений (1) и (2) определяется D, из которого можно рассчитать гидродинамический радиус частиц, используя соотношение Стокса-Эйнштейна:
| (3) |
где k – постоянная Больцмана, T – абсолютная температура, η – динамическая вязкость раствора.
Поскольку на практике мы имели полидисперсные распределения размеров СМН, то из корреляционной функции определялся не один коэффициент диффузии, а их распределение, из чего рассчитывалось распределение по размерам СМН с использованием программы DynaLS (ООО «Фотокор», Россия). Формула (3) связывает размер частицы с её коэффициентом диффузии в предположении, что она является жёсткой сферой. Сферичность СМН в растворах сахаров была ранее подтверждена [19] измерением деполяризации рассеяния. Однако из опыта изучения СMH следует, что они вряд ли являются жёсткими частицами, а скорее аналогом микрокапель. Это следует из работ [15,24–26] и многих других, где показано разрушение СMH фильтрацией [13,32]. Для эмульсионного типа частиц более корректным является аналог формулы (3), полученный с учётом обобщённой силы Стокса [47], в которой учитывается также вязкость субстанции микрокапель:
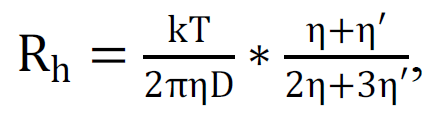 |
(4) |
В нашем случае вязкость субстанции СMH, по-видимому, соизмерима с вязкостью окружения, поэтому приблизительный гидродинамический радиус частиц может быть рассчитан по формуле:
| (5) |
Формула (5) даёт значения на 20 % больше, чем определённые по стандартной методике ДСР (с использованием формулы (3)). В действительности мы не знаем, какова вязкость субстанции СMH, поэтому рассчитанные по формулам (3) и (5), можно считать нижним и верхним пределами. В данной работе для определённости во всех случаях использовалась формула (5), а размер определялся как гидродинамический диаметр.
Все измерения проводили при стабилизированной температуре растворов 25±0.2oС. Каждый отдельно приготовленный раствор измерялся не менее 6 раз.
2.3. Определение разностного коэффициента преломления СМН относительно окружения
В настоящей работе также применялся метод многоуглового статического светорассеяния. Для этого использовался прибор Mastersizer 2000E (Malvern, UK), который является дифракционным анализатором, позволяющим определять распределения по размерам частиц в жидких средах. Для этого измеряется индикатриса рассеяния лазерного излучения (с длиной волны 633 нм) в образце, которая анализируется с помощью теории Ми. Кроме индикатрисы рассеяния образца, содержащего изучаемые частицы, необходимо также измерение фоновой индикатрисы аналогичной жидкой среды, но без частиц. В качестве фонового образца мы использовали те же растворы, пропущенные через фильтр с диаметром пор 20 нм (много меньше размеров СMH) Anotop 10 0.02 mkm (Whatman GmbH, Германия). После фильтрации растворов, методом ДСР удостоверялись в отсутствии СМН в течение часа. Этого времени было достаточно для измерения индикатрисы рассеяния. Измерение индикатрисы рассеяния каждого отдельно приготовленного раствора проводилось не менее 5 раз.
Расчёт распределений по размерам, полученных из индикатрисы по теории Ми, возможен только при известных значениях комплексных коэффициентов преломления жидкой среды и содержащихся в ней частиц, в данном случае СMH. Мнимая часть коэффициента преломления отвечает за поглощение излучения, которое для растворов сахаров при используемой длине волны пренебрежимо мало. Поэтому мы использовали только действительную часть. Коэффициенты преломления среды определялись из справочных данных [48], а коэффициенты преломления СMH изначально были неизвестны. Но в данной работе решалась обратная задача. Подбирался такой коэффициент преломления СMH, при котором рассчитываемые по теории Ми размеры СMH были близки к размерам, определённым методом ДСР. Таким образом, мы определяли не распределения по размерам СMH, а их важный оптический параметр – коэффициент преломления. Подробности разработанной нами экспериментальной процедуры и примеры её применения могут быть найдены в [19].
Отдельно отметим следующее. Согласно принципу Бабине, только на основании данных рассеяния невозможно отличить два случая, когда коэффициент преломления частиц больше и меньше, чем у среды. Можно определить только абсолютное значение разностного коэффициента преломления. Но поскольку СМН считаются образованиями с повышенным содержанием сахара, то и коэффициент преломления должен быть больше, чем у среды, что делает выбор однозначным. Версия наличия стабильных областей раствора с пониженной концентрацией сахаров в настоящей работе рассматривается как нереалистичная.
Результаты
На рисунке 1 представлены характерные распределения по размерам оптических неоднородностей в исследуемых растворах. Пик около 1 нм относится к мономолекулярной фракции сахаров, а пик около 100 нм – к СМН.
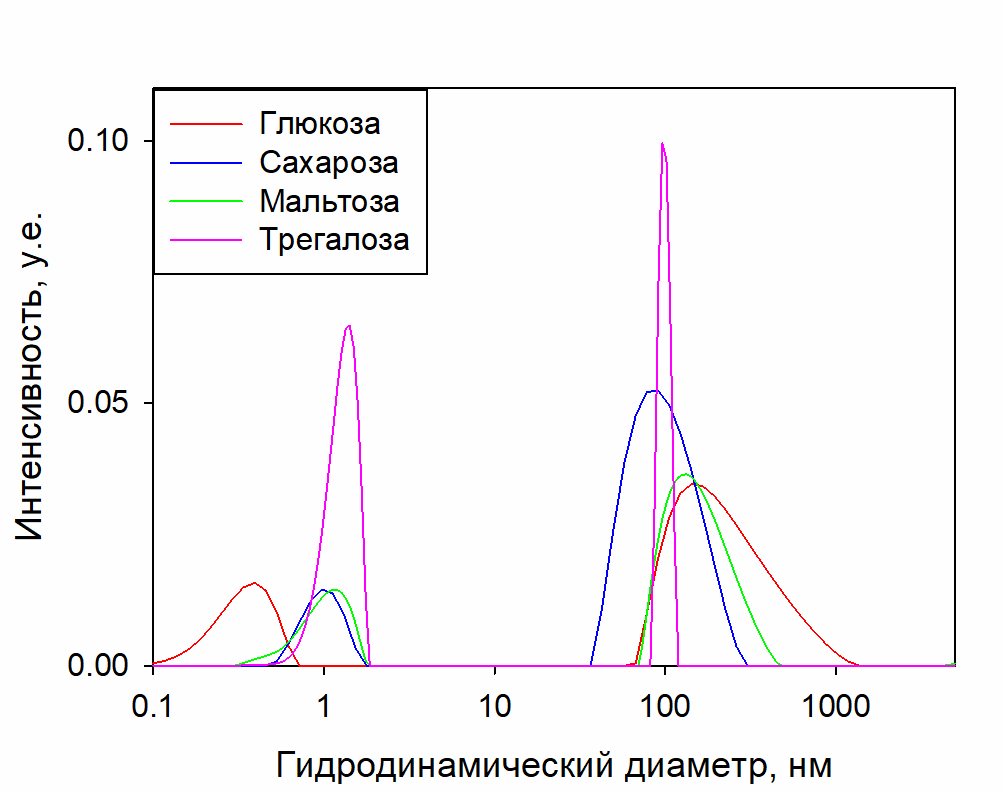
Рисунок 1. Типичные распределения по размерам оптических неоднородностей, определяемые методом ДСР в растворах глюкозы, сахарозы, мальтозы, трегалозы в диапазоне концентраций 0.5-1.5 моль%. Концентрационные изменения распределений не существенны, поэтому не показаны.
На рисунке 2 приведены концентрационные зависимости гидродинамических диаметров СМН в растворах сахаров; на рисунке 3 – интенсивности рассеяния в этих растворах; в таблице 1 – значения разностных коэффициентов преломления СМН относительно средних значений растворов, в которых они находятся.
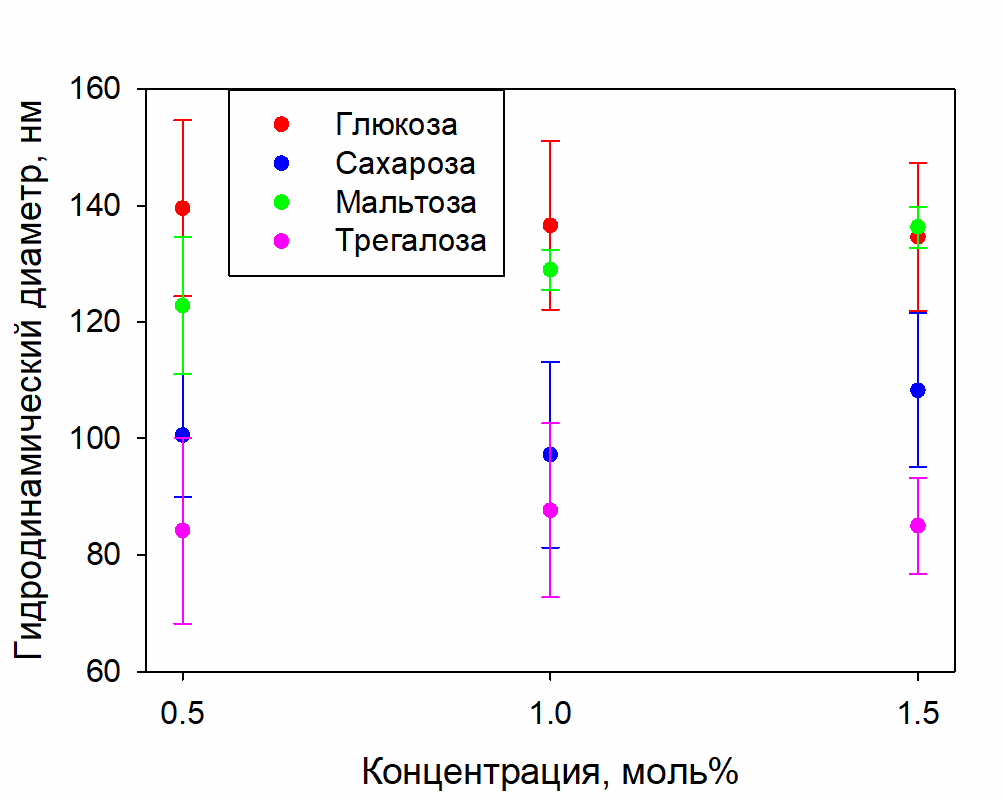
Рисунок 2. Гидродинамические диаметры СМН в растворах глюкозы, сахарозы, мальтозы и трегалозы с концентрациями 0.5, 1, 1.5 моль%
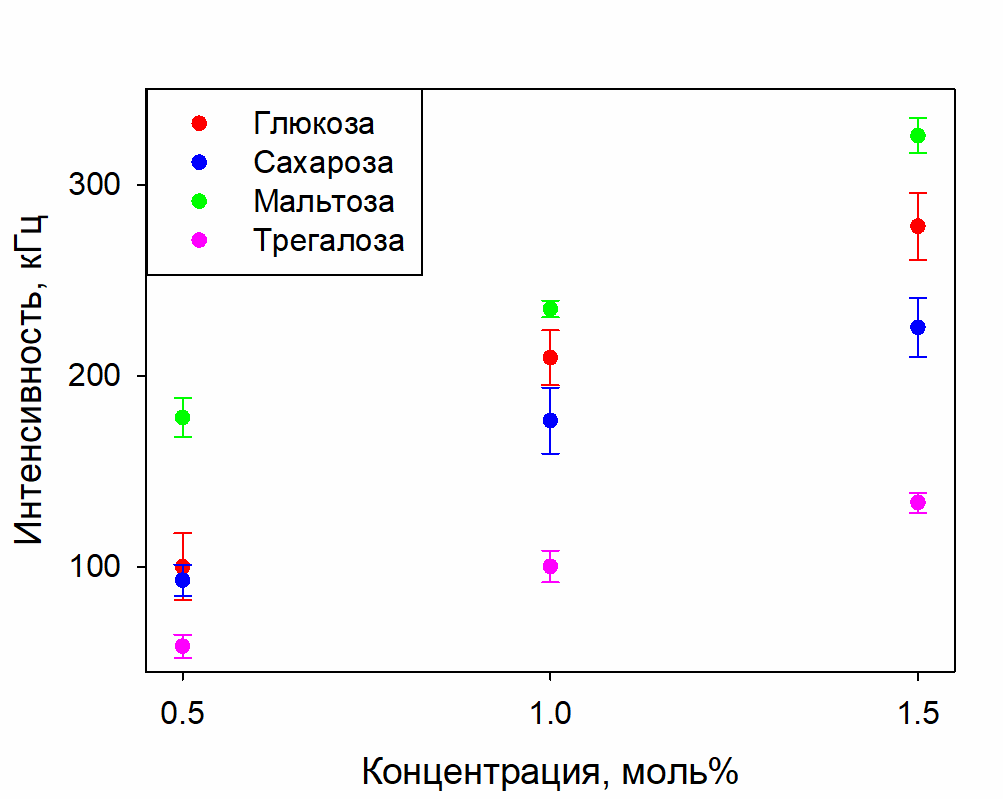
Рисунок 3. Интенсивность рассеяния излучения в растворах глюкозы, сахарозы, мальтозы и трегалозы с концентрациями 0.5, 1, 1.5 моль%
Таблица 1. Разностный коэффициент преломления (Δn) СМН относительно среднего значения в растворах глюкозы, сахарозы, мальтозы и трегалозы с концентрациями 0.5, 1, 1.5 моль%
|
Концентрация, моль% |
0.5 |
1 |
1.5 |
|
Глюкоза |
50 x10-4 |
30 x10-4 |
20 x10-4 |
|
Сахароза |
100 x10-4 |
30 x10-4 |
5 x10-4 |
|
Мальтоза |
40 x10-4 |
20 x10-4 |
30 x10-4 |
|
Трегалоза |
10 x10-4 |
30 x10-4 |
20 x10-4 |
Обсуждение
Рисунок 1 показывает наличие двух чётко определяемых типов неоднородностей в рассматриваемых растворах: отдельные молекулы сахаров (~1 нм) и СМН (~100 нм). При изменении концентрации сахаров в диапазоне 0.5-1.5 моль% распределения по размерам существенно не меняются, ни по соотношению вклада фракций, ни по размеру СМН (рисунок 2).
Из рисунка 3 следует, что с ростом концентрации сахаров в диапазоне 0.5-1.5 моль% происходит увеличение интенсивности рассеяния. При слабо меняющихся распределениях по размерам это может быть связано с двумя факторами: увеличение Δn и увеличение концентрации. Из Таблицы 1 следует, что Δn либо уменьшается, либо остаётся примерно одинаковым с ростом концентрации для всех сахаров. Поэтому увеличение интенсивности рассеяния может быть связано только с увеличением концентрации СМН.
Отметим, что полученные значения Δn ~ 0.001–0.01 (Таблица 1) аномально малы, по сравнению с обычными коллоидными растворами. Например, у молока, представляющего собой эмульсию жира в воде, Δn≈0.14. Рассеивающая способность сферической неоднородности в среде определяется по формуле:
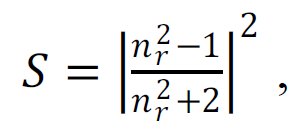 |
(6) |
где, nr – относительный коэффициент преломления. Таким образом, при сопоставимых размерах рассеивающая способность жировых капель в 103–104 раз больше, чем, например, СМН в растворах трегалозы. Это даёт количественное понимание того, почему данный тип гетерогенности, как правило, незаметен при работе с растворами органики. Для регистрации СМН нужно применение специализированных методов светорассеяния.
Из таблицы 1 следует, что концентрационные зависимости Δn могут сильно отличаться между растворами разного типа сахаров. С увеличением концентрации глюкозы и сахарозы Δn монотонно уменьшается, тогда как для мальтозы и трегалозы эта зависимость немонотонна. Значение Δn прямо связано с отличием концентрации сахара в СМН от среднего значения в растворе. Поэтому состав (и, возможно, структура) СМН в растворах органики может сильно отличаться даже при небольших отличиях структуры органических молекул и одинаковой их концентрации.
Обращаем внимание, что при концентрации 0.5 моль% в растворе трегалозы значение Δn значительно меньше, чем у остальных сахаров. Концентрация дисахарида 0.5 моль% (~10 вес%) соответствует типичным концентрациям сахаров, использующимся во многих криопротекторных растворах. Как известно, трегалоза проявляет наиболее сильные криопротекторные свойства по сравнению с другими низкомолекулярными сахарами, объяснение чего является предметом дискуссий уже долгое время, как среди биологов, так и физ-химиков [49–55]. При этом малый разностный коэффициент преломления СМН в растворе трегалозы означает малый плотностный контраст. А это делает СМН менее пригодными для гетерогенной нуклеации льда при охлаждении раствора.
Кроме того, учитывая различия в рассеивающей способности (таблица 1 и формула (6)) и интенсивности рассеяния (рисунок 3), концентрация СМН в растворе трегалозы 0.5 моль% на 2 порядка больше, чем, например, в аналогичном растворе сахарозы. При достаточно сильном переохлаждении раствора, когда движущая сила кристаллизации делает возможным нуклеацию льда на СМН, чем больше СМН, тем больше образуется кристаллов льда. При одинаковой общей массе образующегося льда, в растворе трегалозы средний размер кристаллов будет меньше, чем в остальных растворах. А это способствует меньшему повреждающему действию на биообъект.
В современных подходах криоконсервации прилагается немало усилий для подбора смесей сахаров (часто вместе с проникающими криопротекторами) для достижения наиболее эффективного влияния на процессы образования и роста кристаллов льда [56,57]. Однако в основном этот подбор проводится эмпирически, с ориентацией на результат, но без осмысления процессов на фундаментальном физико-химическом уровне. Наличие СМН в таких растворах никогда не учитывалось, хотя они могут выступать в качестве центров кристаллизации или, наоборот, ингибиторов роста кристаллов льда. Это, конечно, требует дальнейшего изучения с использованием большего количества веществ и в режимах переохлаждения растворов.
Заключение
В водных растворах четырёх сахаров – глюкозы, сахарозы, мальтозы и трегалозы – в концентрациях от 0.5 до 1.5 моль% методами светорассеяния зарегистрированы стабильные субмикронные неоднородности. С ростом концентрации сахаров наблюдается увеличение интенсивности рассеяния света в растворах, что свидетельствует о росте числовой концентрации СМН, при этом их размеры практически не меняются. Определены дифференциальные коэффициенты преломления СМН относительно среднего значения в растворах: 0.001–0.01, которые намного меньше типичных значений для коллоидов. Это объясняет малозаметность СМН для большинства экспериментальных методов. Значения дифференциальных коэффициентов преломления СМН могут сильно отличаться между растворами химически и структурно близких органических молекул, например, дисахаридов. При концентрациях сахаров ~10 вес%, типичных для криопротекторных растворов, у раствора трегалозы наблюдается гораздо меньшее значение дифференциального коэффициента преломления СМН, по сравнению с остальными сахарами, что означает также наименьший плотностный контраст СМН в данном растворе. При этом числовая концентрация СМН в растворе трегалозы наибольшая. Впервые рассмотрена возможная роль СМН в процессах криозащиты. Сделано предположение о связи наименьшего дифференциального коэффициента преломления СМН и их наибольшей концентрации в растворе трегалозы с наибольшей криопротекторной эффективностью трегалозы среди других низкомолекулярных сахаров.
Часть работы была выполнена с использованием оборудования Сектора Оптической микроскопии и спектрофотометрии ЦКП ПНЦБИ РАН (https://www.pbcras.ru/services/tskp/).
Список литературы
- Vuks M. F., and Shurupova L. V. The scattering of light and phase transition in solutions of tertiary butyl alcohol in Opt Commun., 5 (4), 277-278 (1972). DOI: 10.1016/0030-4018(72)90096-X
- Beer C. W., and Jolly D. J. Comments on “the scattering of light and phase transition in solutions of tertiary butyl alcohol in ” Opt Commun., 11 (2), 150-151 (1974). DOI: 10.1016/0030-4018(74)90205-3
- Iwasaki K., and Fujiyama T. Light-scattering study of clathrate hydrate formation in binary mixtures of tert-butyl alcohol and water. Temperature effect. J Phys Chem., 83 (4), 463-468 (1979). DOI: 10.1021/ j100467a008
- Kostko A. F., Anisimov M. A., and Sengers J. V. Criticality in aqueous solutions of 3-methylpyridine and sodium Phys Rev E., 70 (2), 026118 (2004). DOI: 10.1103/PhysRevE.70.026118
- Jin , Ye J., Hong L., Lam H., and Wu C. Slow relaxation mode in mixtures of water and organic mol- ecules: supramolecular structures or nanobubbles? J Phys Chem B., 111 (9), 2255-2261 (2007). DOI: 10.1021/ jp068665w
- Kononov O. Chemical reactivity and solution structure: on the way to a paradigm shift? RSC Adv., 5 (58), 46718-46734 (2015). DOI: 10.1039/C4RA17257D
- Medzhitov R. A., Buchelnikov A. S., Lantushenko A. O., and Evstigneev M. P. Rationalizing DLS size distributions of fullerene conjugates. Fullerenes, Nanotub Carbon Nanostructures, 1-5 (2024). DOI: 1080/1536383X.2024.2392030
- Sedlák M. Large-scale supramolecular structure in solutions of low molar mass compounds and mix- tures of liquids: Light scattering characterization. J Phys Chem B., 110 (9), 4329-4338 (2006). DOI: 10.1021/ jp0569335
- Sedlák M. Large-scale supramolecular structure in solutions of low molar mass compounds and mix- tures of liquids: Kinetics of the formation and long-time stability. J Phys Chem B., 110 (9), 4339-4345 (2006). DOI: 10.1021/jp056934x
- Sedlák Large-scale supramolecular structure in solutions of low molar mass compounds and mix- tures of liquids. III. Correlation with molecular properties and interactions. J Phys Chem B., 110 (28), 13976- 13984 (2006). DOI: 10.1021/jp061919t
- Subramanian D., Boughter C. T., Klauda J. B., Hammouda B., and Anisimov M. A. Mesoscale inho- mogeneities in aqueous solutions of small amphiphilic Faraday Discuss., 167, 217-238 (2013). DOI: 10.1039/c3fd00070b
- Subramanian D., Klauda J. B., Collings P. J., and Anisimov M. A. Mesoscale phenomena in ternary solutions of tertiary butyl alcohol, water, and propylene oxide. J Phys Chem B., 118 (22), 5994-6006 (2014). DOI: 1021/jp4125183
- Subramanian , Ivanov D. A., Yudin I. K., Anisimov M. A., and Sengers J. V. Mesoscale inhomoge- neities in aqueous solutions of 3-methylpyridine and tertiary butyl alcohol. J Chem Eng Data., 56 (4), 1238-1248 (2011). DOI: 10.1021/je101125e
- Li Z., Cheng H., Li J., Jinkun H., Li Z., Boualem H., and Charles C. H. Large-scale structures in tet- rahydrofuran–water mixture with a trace amount of antioxidant butylhydroxytoluene (BHT). J Phys Chem B., 115 (24), 7887-7895 (2011). DOI: 1021/jp203777g
- Bunkin N. F., Shkirin A. V., Lyakhov G. A., Kobelev A. V., Penkov N. V., Ugraitskaya S. V., and Fesenko E. E. Droplet-like heterogeneity of aqueous tetrahydrofuran solutions at the submicrometer scale. J Chem , 145 (18), 184501 (2016). DOI: 10.1063/1.4966187
- Chaikov L., Kovalenko K. V., Krivokhizha S. V., Kudryavtseva A. D., Tareeva M. V., Tcherniega V., and Shevchenko M. A. Structure of water microemulsion particles: study by optical methods. Phys Wave Phenom., 27 (2), 87-90 (2019). DOI: 10.3103/S1541308X1902002X
- Orlova V., Andrade R. R., da Silva C. O., Zinin A. I., and Kononov L. O. Polarimetry as a tool for the study of solutions of chiral solutes. ChemPhysChem., 15 (1), 195-207 (2014). DOI: 10.1002/cphc.201300894
- Jawor-Baczynska A., Moore B. D., Lee H. S., McCormick A. V., and Sefcik J. Population and size distribution of solute-rich mesospecies within mesostructured aqueous amino acid solutions. Faraday Discuss., 167, 425-440 (2013). DOI: 1039/c3fd00066d
- Penkov V., Zhmurin V. A., Kobelev A. V., Fesenko (Jr.) E. E., and Penkova N. A. Dispersed, optical and concentration characteristics of submicron heterogeneities in aqueous solutions of sugars. J Mol Liq., 398, 124281 (2024). DOI: 10.1016/j.molliq.2024.124281
- Penkov V., Zhmurin V. A., Manokhin A. A., Kobelev A. V., and Penkova N. A. Capillary effects of submicron heterogeneities in aqueous solutions of sugars. The additional mechanism of microfluidics. J Mol Liq., 410, 125638 (2024). DOI: 10.1016/j.molliq.2024.125638
- Penkov V., Penkova N. A., Zhmurin V. A., and Pogorelov A. G. Natural submicron heterogeneities in aqueous solutions of ATP. Phys Wave Phenom., 32 (3), 178-186 (2024). DOI: 10.3103/S1541308X24700134
- Sedlák M., and Rak D. On the origin of mesoscale structures in aqueous solutions of tertiary butyl alcohol: The mystery J Phys Chem B, 118 (10), 2726-2737 (2014). DOI: 10.1021/jp500953m
- Rak D., and Sedlák M. Solvophobicity-driven mesoscale structures: stabilizer-free nanodispersions. Langmuir, 39 (4), 1515-1528 (2023). DOI: 1021/acs.langmuir.2c02911
- Bunkin F., Lyakhov G. A., Shkirin A. V., Kobelev A. V., Penkov N. V., Ugraitskaya S. V., and Fesen- ko (Jr.) E. E. Study of the submicron heterogeneity of aqueous solutions of hydrogen-bond acceptor molecules by laser diagnostics methods. Phys Wave Phenom., 23 (4), 241-254 (2015). DOI: 10.3103/S1541308X15040019
- Bunkin F., Lyakhov G. A, Shkirin A. V., Krivokhizha S. V., Afonin A. A., Kobelev A. V., Penkov N. V., and Fesenko E. E. Laser diagnostics of the mesoscale heterogeneity of aqueous solutions of polar organic compounds. Phys Wave Phenom., 26 (1), 21-35 (2018). DOI: 10.3103/S1541308X18010041
- Bunkin F., Lyakhov G. A., Shkirin A. V., Ignatiev P. S., Kobelev A. V., Penkov N. V., and Fesenko E. E. Mesodroplet heterogeneity of low-concentration aqueous solutions of polar organic compounds. Phys Wave Phenom., 27 (2), 91-101 (2019). DOI: 10.3103/S1541308X19020031
- Cainelli , Galletti P., and Giacomini D. Solvent effects on stereoselectivity: more than just an envi- ronment. Chem Soc Rev., 38 (4), 990-1001 (2009). DOI: 10.1039/b802815j
- Jin , Li J., Ye X., and Wu C. Effects of pH and ionic strength on the stability of nanobubbles in aque- ous solutions of α-cyclodextrin. J Phys Chem B, 111 (40), 11745-11749 (2007). DOI: 10.1021/jp074260f
- Jin F., Ye X., and Wu C. Observation of kinetic and structural scalings during slow coalescence of nanobubbles in an aqueous J Phys Chem B, 111 (46), 13143-13146 (2007). DOI: 10.1021/jp077190l
- Sedlák M., and Rak D. Large-scale inhomogeneities in solutions of low molar mass compounds and mixtures of liquids: Supramolecular structures or nanobubbles? J Phys Chem B, 117 (8), 2495-2504 (2013). DOI: 1021/jp4002093
- Häbich A., Ducker W., Dunstan D. E., and Zhang X. Do stable nanobubbles exist in mixtures of or- ganic solvents and water? J Phys Chem B, 114 (20), 6962-69672010. DOI: 1021/jp911868j
- Subramanian D., and Anisimov M. A. Resolving the mystery of aqueous solutions of tertiary butyl J Phys Chem B, 115 (29), 9179-9183 (2011). DOI: 10.1021/jp2041795
- Rak D., Ovadová M., and Sedlák M. (Non)existence of bulk nanobubbles: The role of ultrasonic cavitation and organic solutes in water. J Phys Chem Lett., 10 (15), 4215-4221 (2019). DOI: 10.1021/acs.jp- 9b01402
- Bunkin N. F., and Bunkin F. V. Bubston structure of water and electrolyte aqueous solutions. Phys- ics-Uspekhi., 59 (9), 846-865 (2016). DOI: 3367/UFNe.2016.05.037796
- Yurchenko O., Shkirin A. V., Ninham B. W., Sychev A. A., Babenko V. A., Penkov N. V., Kryuch- kov N. P., and Bunkin N. F. Ion-specific and thermal effects in the stabilization of the gas nanobubble phase in bulk aqueous electrolyte solutions. Langmuir, 32 (43), 11245-11255 (2016). DOI: 10.1021/acs.langmuir.6b01644
- Bunkin F., Shkirin A. V., Penkov N. V., Goltayev M. V., Ignatiev P. S., Gudkov S. V., and Izmai- lov A. Yu. Effect of gas type and its pressure on nanobubble generation. Front Chem., 9, 630074 (2021). DOI: 10.3389/fchem.2021.630074
- Bunkin F., Shkirin A. V., Suyazov N. V., Babenko V. A., Sychev A. A., Penkov N. V., Belosludtsev N., and Gudkov S. V. Formation and dynamics of ion-stabilized gas nanobubble phase in the bulk of aqueous NaCl solutions. J Phys Chem B, 120 (7), 1291-1303 (2016). DOI: 10.1021/acs.jpcb.5b11103
- Georgalis Y., Kierzek A. M., and Saenger W. Cluster formation in aqueous electrolyte solutions ob- served by dynamic light J Phys Chem B, 104 (15), 3405-3406 (2000). DOI: 10.1021/jp000132e
- Penkov N. V. Application of terahertz time-domain spectroscopy to study the microheterogeneities of solutions: A case study of aqueous sugar solutions. Photonics, 10 (8), 887 (2023). DOI: 10.3390/photon- ics10080887
- Hagmeyer , Ruesing J., Fenske T., Klein H.-W., Schmuck C., Schrader W., Piedade M. E. Minas da, and Epple M. Direct experimental observation of the aggregation of α-amino acids into 100–200 nm clusters in aqueous solution. RSC Adv., 2 (11), 4690-4696 (2012). DOI: 10.1039/c2ra01352e
- Rademacher W., Parekh R. B., and Dwek R. A. Glycobiology. Annu Rev Biochem., 57 (1), 785-838 (1988). DOI: 10.1146/annurev.bi.57.070188.004033
- Sanders L. M. Carbohydrate: Digestion, Absorption and Metabolism. In: Encyclopedia of Food and Health, by B. Caballero, P. M. Finglas, F. Toldra (Oxford, Academic Press, 2016), pp. 643-650. DOI: 10.1016/ B978-0-12-384947-2.00114-8
- Wang C., Chantraine C., Viljoen A., Herr A. B., Fey P. D., Horswill A. R., Mathelié-Guinlet , and Dufrêne Y. F. The staphylococcal biofilm protein Aap mediates cell–cell adhesion through mechanically distinct homophilic and lectin interactions. PNAS Nexus, 1 (5), 278 (2022). DOI: 10.1093/pnasnexus/pgac278
- Grzesik K., and Hoja-Łukowicz D. Rola glikanów w rozwoju i progresji nowotworu. Zastosowania Postepy Biochem., 67 (2), 104-116 (2021). DOI: 10.18388/pb.2021_385
- Jain K., and Roy I. Effect of trehalose on protein structure. Protein Sci., 18 (1), 24-36 (2008). DOI: 10.1002/pro.3
- Berne B. J., and Pecora R. Dynamic Light Scattering: With Applications to Chemistry, Biology, and Physics (Dover Publications, 1976).
- Landau L. D., and Lifshitz E. M. Fluid Mechanics. Course of Theoretical Physics. (2nd ed. Butter- worth–Heinemann, 1987), Vol 6.
- Astle J., Beyer W. H., and Allen J. A. Van. Handbook of Chemistry and Physics, Weast R. C., ed. (CRC Press, 1984).
- Crowe M., Mouradian R., Crowe J. H., Jackson S. A., and Womersley C. Effects of carbohydrates on membrane stability at low water activities. Biochim Biophys Acta - Biomembr., 769 (1), 141-150 (1984). DOI: 10.1016/0005-2736(84)90017-8
- Ahmad E., and Aksoy M. Trehalose as a cryoprotective agent for the sperm cells: a mini review. Anim Heal Prod , 1 (2), 123-129 (2012). https://www.researchgate.net/publication/235719676_Trehalose_ as_a_Cryoprotective_Agent_for_the_Sperm_Cells_A_mini_review
- Huang , Zhao G., Zhang Y., Xu J., Toth T. L., and He X. Predehydration and ice seeding in the pres- ence of trehalose enable cell cryopreservation. ACS Biomater Sci Eng., 3 (8), 1758-1768 (2017). DOI: 10.1021/ acsbiomaterials.7b00201
- Crowe H., Crowe L. M., and Chapman D. Preservation of membranes in anhydrobiotic organisms: The role of trehalose. Science, 223 (4637), 701-703 (1984). DOI: 10.1126/science.223.4637.701
- Branca C., Magazù S., Maisano G., Migliardo F., Migliardo P., and Romeo G. α,α-Trehalose/Water 5. Hydration and viscosity in dilute and semidilute disaccharide solutions. J Phys Chem B, 105 (41), 10140-10145 (2001). DOI: 10.1021/jp010179f
- Kawai H., Sakurai M., Inoue Y., Chûjô R., and Kobayashi S. Hydration of oligosaccharides: anom- alous hydration ability of Cryobiology, 29 (5), 599-606 (1992). DOI: 10.1016/0011-2240(92)90064-9
- Heyden , Bründermann E., Heugen U., Niehues G., Leitner D. M., Havenith M. Long-range influ- ence of carbohydrates on the solvation dynamics of water—answers from terahertz absorption measurements and molecular modeling simulations. J Am Chem Soc., 130 (17), 5773-5779 (2008). DOI: 10.1021/ja0781083
- Yong W., Laouar L., Elliott J. A. W., Jomha N. M. Review of non-permeating cryoprotectants as supplements for vitrification of mammalian tissues. Cryobiology, 96, 1-11 (2020). DOI: 10.1016/j.cryobi- ol.2020.08.012
- Murray A., Gibson M. I. Chemical approaches to cryopreservation. Nat Rev Chem., 6 (8), 579-593 (2022). DOI: 10.1038/s41570-022-00407-4
Лицензия
Copyright (c) 2025 Никита Пеньков, В.А. Жмурин, Е.Е. Фесенко (мл.) (Автор)

Это произведение доступно по лицензии Creative Commons «Attribution-NonCommercial» («Атрибуция — Некоммерческое использование») 4.0 Всемирная.