Вязкость витрифицирующего раствора этиленгликоля в присутствии клатратообразующих газов Xe и Kr, измеренная методом динамического светорассеяния
- Организации
-
- 1. Институт биофизики клетки РАН ФИЦ ПНЦБИ РАН
- Опубликован:
- 2024-11-07
- Ключевые слова:
- криоконсервация, витрификация, витрифицирующий раствор, газовые гидраты, вязкость, ксенон, криптон, динамическое светорассеяние
Аннотация
Текущее состояние криобиологии характеризуется интенсивным развитием методов криоконсервации, основанных на витрификации (стекловании) водной фазы замораживаемого объекта. Одной из актуальных проблем является поиск путей снижения концентрации витрифицирующих агентов (криопротекторов), обеспечивающих стеклование, с целью минимизации токсического воздействия на замораживаемые клетки или ткани. В данной работе предложен новый экспериментальный подход, позволяющий повысить вязкость витрифицирующих растворов за счёт насыщения их инертными газами. В основе повышения вязкости лежит процесс гидратообразования, реализующийся при низких температурах и приводящий к переходу части воды в кристаллы газового гидрата. Снижение общего содержания воды в растворе приводит к концентрированию витрифицирующего агента и повышению вязкости. В работе экспериментально подтверждено увеличение вязкости 56,4 об.% водного раствора этиленгликоля, реализуемое в условиях повышенного давления Xe (9 атм.) и Kr (50 атм.) в диапазоне температур от -20 до -40°С. Для измерения вязкости под давлением при низких температурах впервые был адаптирован метод динамического светорассеяния.
Полный текст
Введение
Текущее состояние криобиологии характеризуется интенсивным развитием методов криоконсервации, основанных на витрификации (стекловании) водной фазы замораживаемого объекта. Охлаждение с высокими скоростями до температур стеклования позволяет свести к минимуму или полностью нивелировать основной повреждающий фактор, заключающийся в образовании кристаллов льда [1-3]. Поскольку скорость охлаждения макрообъектов лимитирована конечными значениями температуропроводности, для осуществления витрификации необходимо повышать вязкость среды, поскольку ее высокое значение замедляет процесс образования кристаллов [4-5]. Чем больше вязкость среды, тем медленнее можно охлаждать витрифицируемый объект. На практике для витрификации используют специальные растворы криопротекторов, повышающие вязкость среды, – витрифицирующие растворы. В качестве криопротекторов используют этиленгликоль, пропиленгликоль, ДМСО и др. Эти вещества или их композиции в используемых для витрификации высоких концентрациях, суммарно 8-9М, проявляют высокую токсичность [6,7]. Таким образом, для достижения эффективной витрификации необходимо повышать концентрацию криопротектора, в то время как для минимизации токсического эффекта концентрацию криопротекторов, наоборот, требуется снижать. Следует отметить, что токсичность криопротекторов при одной и той же концентрации, как правило, уменьшается с понижением температуры, поэтому насыщение объекта криопротектором стремятся проводить в несколько стадий с постепенным снижением температуры в интервале от +20°С – до -20°С и ступенчатым повышением концентрации. Понижение температуры насыщения замораживаемого объекта лимитировано как его холодовым повреждением, так и снижением диффузии криопротектора, что сказывается на эффективности его распределения в объеме объекта. Исходя из этого, актуальной представляется задача поиска способа снижения концентрации криопротектора в растворе при начальных температурах насыщения и повышения концентрации на более низких температурах с целью обеспечения требуемых значений вязкости.
Нами была выдвинута гипотеза [8], что достичь этого можно путём связывания части воды из раствора за счёт образования клатратных гидратов инертных газов, таких как ксенон, криптон и аргон. Для этого нужно охлаждать витрифицирующий раствор под внешним давлением гидратообразующих газов и при достижении соответствующих термобарических условий начнёт происходить образование газогидратов. В течение этого процесса будет снижаться концентрация воды в растворе и увеличиваться вязкость. Присутствие в растворе растворённых инертных газов, в отличие от подавляющего большинства других веществ, влияющих на вязкость, не оказывает токсического эффекта.
Каждому газу соответствуют определённые термобарические условия гидратообразования, причём эти условия надёжно установлены лишь для чистой воды и некоторых растворов [9-11]. Для водных растворов с высоким содержанием криопротекторов (витрифицирующие растворы) они неизвестны. Можно лишь утверждать, что образование гидратов будет происходить на температурах существенно более низких по сравнению с водой при одних и тех же давлениях газа.
Целями настоящей работы были (1) разработка методологии, обеспечивающей определение вязкости растворов под давлением при пониженных температурах в «реальном времени»; (2) оценка термобарических условий, при которых происходит образование газогидратов в растворах с высоким содержанием витрифицирующих агентов; (3) проверка гипотезы о повышении вязкости витрифицирующего раствора в условиях давления инертного газа.
Материалы и методы
Реактивы и условия измерений
Были проведены эксперименты по определению вязкости водного раствора одного из наиболее часто используемых криопротекторов – этиленгликоля (Sigma-Aldrich, США) под давлением криптона и ксенона («НИИ КМ», Россия, чистота не менее 4.0). Для экспериментов был выбран водный раствор с объёмным содержанием этиленгликоля 56,4 об.% (одна из стандартных концентраций, используемых для приготовления витрифицирующих растворов). Измерения проводились в температурном диапазоне от +20 до -40°С. Давление криптона в серии экспериментов составляло 50 атм., ксенона 9 атм. Контрольный эксперимент проводили без приложения давления.
Метод измерения вязкости
Для измерения вязкости был использован оптический метод динамического рассеяния света (DLS), который ранее был опробован для измерения вязкости воды, насыщенной углекислым газом [12].
Метод DLS изначально создавался для измерения размеров частиц в жидких средах, и суть его заключается в измерении корреляционной функции интенсивности рассеянного лазерного луча от среды, содержащей частицы. Поскольку частицы подвержены броуновскому движению, то возникают флуктуации их концентрации и, следовательно, флуктуации коэффициента преломления. Рассеянное на этих флуктуация излучение регистрируется под определённым углом и определяется временная корреляционная функция интенсивности. Временные корреляции полностью определяются коэффициентами диффузии частиц. Для монодисперсного распределения частиц корреляционная функция связана с коэффициентом диффузии следующим образом:
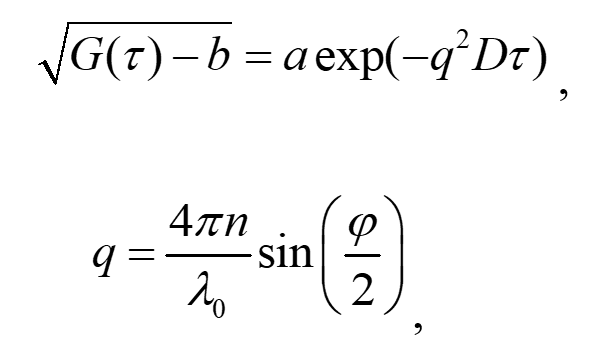 (1)
(1)
где τ – время задержки, a и b – экспериментальные константы, q–вектор рассеяния, D – коэффициент диффузии частиц, l0 – длина волны лазерного излучения в вакууме, n – коэффициент преломления жидкой фазы, φ – угол рассеяния.
Таким образом, метод позволяет определить коэффициент диффузии частиц (в более общем случае распределение коэффициентов диффузии), а после этого на основании соотношения Стокса-Эйнштейна рассчитывается гидродинамический радиус частиц, в предположении их сферической формы:
R=kT/6πηD (2)
где k – постоянная Больцмана, T – абсолютная температура, η – динамическая вязкость. При этом, как следует из формулы (2), для корректного определения размера необходимо точное задание динамической вязкости η. Однако возможна постановка обратной задачи: использовать измеренные значения коэффициентов диффузии частиц известного размера для расчета вязкости среды по формуле:
η=kT/6πRD (3)
Поскольку метод DLS является бесконтактным, то можно в широких пределах температур и давлений производить измерения вязкости среды. Единственным условием является оптическая прозрачность рабочей камеры.
Конструкция измерительной кюветы-барокамеры
Нами была сконструирована кювета, схематично изображённая на рисунке 1А. Корпус кюветы изготовлен из беррилиевой бронзы. Оптическое окно изготовлено из лейкосапфира в форме цилиндрического кольца с внутренним диаметром 10 мм, внешним диаметром 30 мм и высотой 10 мм. Пространство внутри кольца составляет область, заполненную исследуемым раствором, в которую направлен лазерный луч. В кювету подаётся газ под давлением, которое измеряется манометром непосредственно перед кюветой с точностью 0,5 атм. Сверху в кювету вводится термопара, которая измеряет температуру жидкости с точностью 0,1 °С.
Подбор эталонных частиц для измерения вязкости методом DLS
Как следует из формулы (3), для измерения вязкости методом DLS необходимо использовать частицы с известным радиусом R. Материал частиц сам по себе не имеет значения в контексте используемого метода, однако необходимо соблюдение ряда условий: 1 – распределение размеров частиц должно быть близким к мономодальному; 2 – частицы должны обладать агрегационной стабильностью в течение времени проведения эксперимента; 3 – размер частиц должен быть не очень велик – менее 10 микрометров (верхний предел применимости метода DLS) и в то же время не очень мал (более 50 нанометров) для обеспечения достаточной интенсивности рассеяния при небольших концентрациях частиц; 3 – частицы не должны обладать химической активностью к среде, в которой они диспергированы.
В работе использовали опытные наночастицы производства «Биовакс», Россия. Заявленный производителем средний радиус частиц составил 52±2 нм. Размер частиц, определённый нами с помощью метода DLS, составил 53±2 нм. Исходный образец, содержащий указанные частицы, представлял собой суспензию в воде. Для получения сильного сигнала рассеяния было достаточно добавить в исследуемый раствор 1 об.% суспензии. Данная добавка водной суспензии не оказывала влияния на вязкость исследуемого раствора.
Система охлаждения
Охлаждение осуществлялось с помощью специально разработанной системы подачи испаряющегося азота в рубашку держателя кюветы. Схема системы охлаждения представлена на рисунке 1Б. В сосуд Дьюара, заполненный жидким азотом, введена трубка с нагревателем. Пространство между внешней стороной трубки и горловиной сосуда Дьюара герметизировано. После включения нагревателя происходило интенсивное испарение азота и выход его под давлением по трубке, которая соединена шлангом с рубашкой кюветы. Поток холодного азота регулировался напряжением, подаваемым на нагреватель. Существенной деталью системы охлаждения служило то, что азот из охлаждающей рубашки кюветы по трубке направлялся в кюветное отделение анализатора частиц для обдува оптической части кюветы. Это позволило предотвратить конденсацию воды на окнах кюветы и повысить эффективность охлаждения кюветы, сделав его более равномерным.
Измерение вязкости
Измерение вязкости производили на анализаторе размеров частиц Photocor Complex («Photocor», Россия). Использовали лазер с длиной волны 451 нм, мощностью 25 мВт. Кювету устанавливали в кюветное отделение прибора. Лазерное излучение, рассеянное в образце, регистрировали лавинным фотодиодом под углом 120° к направлению падающего луча.
Измерение вязкости выполняли в процессе охлаждения исследуемого раствора. Скорость охлаждения составляла 0,5°С/мин. Время одного измерения вязкости составляло 2 мин. Таким образом, изменение температуры во время единичного процесса измерения вязкости не превышало 1°С. Эксперименты проводили в 10 повторностях.
Для контрольного раствора (56,4 об.% раствора этиленгликоля при температуре +20°С без внешнего давления) было проведено сравнение значений вязкости, полученных методом DLS и измеренных с помощью синусоидального вибро-вискозиметра SV-10 (A&D Company Limited, Япония). Эксперимент проводили в 3 повторностях.
Статистическая обработка
Анализ данных проводили с помощью программного обеспечения SigmaPlot 12.5 (Systat Software Inc, США); данные выражали в виде среднего значения ± стандартное отклонение. Значимость различий определяли с использованием U-критерия Манна-Уитни. Значения с p <0.05 считались статистически значимыми.
Результаты
Проверка корректности измерения вязкости методом динамического светорассеяния
Для проверки корректности применяемого метода определения вязкости был проведён эксперимент по измерению вязкости 56,4 об.% раствора этиленгликоля при температуре +20°С без внешнего давления методом DLS и с использованием синусоидального вибро-вискозиметра. Значение динамической вязкости, полученное обоими методами, составило 4,8±0,2 сП. Также было проведено сравнение измеренной нами температурной зависимости вязкости 56,4 об.% раствора этиленгликоля без подачи газов и аналогичной зависимости, приведенной в [13] (рис. 1В).
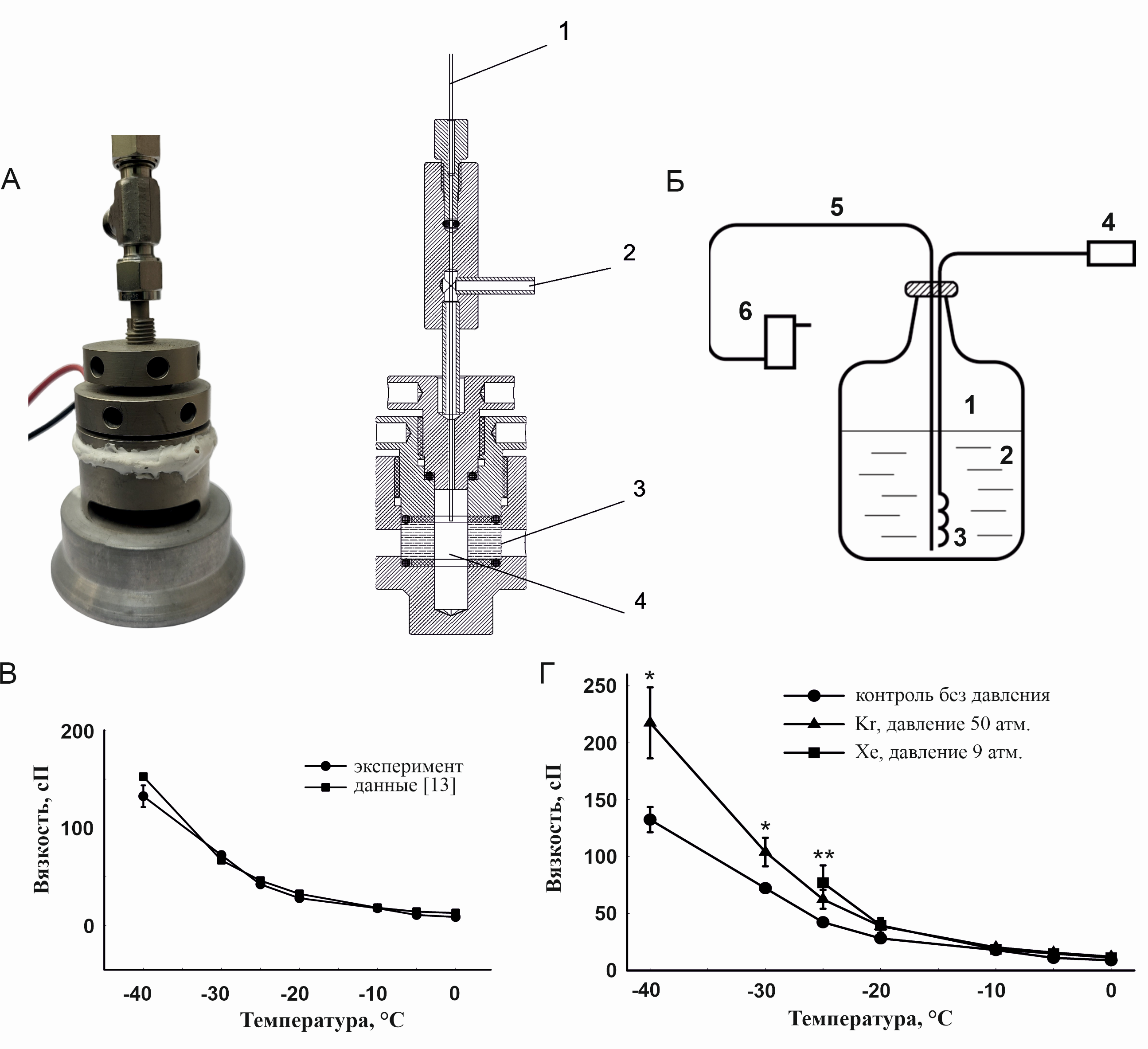
Рисунок 1. Динамическая вязкость водного раствора этиленгликоля 56,4 об.% под давлением ксенона и криптона. А – фотография и эскиз кюветы-барокамеры для измерения вязкости среды методом динамического светорассеяния под давлением и с контролем температуры: 1 – датчик температуры, 2 – подача газа, 3 – лейкосапфировое окно, 4 – исследуемый раствор; Б – схема системы охлаждения кюветы-барокамеры: 1 – сосуд Дьюара, 2 – жидкий азот, 3 – нагреватель, 4 – блок управления нагревателем, 5 – термоизолированный канал, 6 – рубашка охлаждения кюветы; В – зависимости вязкости водного раствора этиленгликоля 56,4 об.% от температуры без подачи газа, полученные экспериментально с помощью метода DLS (круг) и приведенные в работе [13] (квадрат). Г – экспериментальные значения динамической вязкости водного раствора этиленгликоля 56,4 об.% без давления (круг), под давлением 9 атм. ксенона (квадрат), под давлением 50 атм. криптона (треугольник). Данные представлены в виде среднее ± стандартное отклонение, n=10. Различия достоверны (U-критерий) по отношению к группе «контроль без давления»: *p<0.05 для группы «Kr», **p<0.05 для группы «Xe».
Вязкость раствора этиленгликоля под давлением ксенона и криптона
На рисунке 1Г представлены зависимости вязкости 56,4 об.% водного раствора этиленгликоля от температуры под давлением криптона и ксенона, а также контрольная зависимость без подачи газа. Минимальная температура, до которой удавалось измерять вязкость, – это температура, при которой начиналось активное кристаллообразование (предположительно массивное образование гидрата). При этом на пути лазерного луча появлялось большое количество крупных оптических неоднородностей, которые не позволяли далее использовать метод DLS. Поскольку кристаллообразование (образование газового гидрата либо льда) – процесс стохастический, в последовательности однотипных экспериментов оно реализовывалось при разных температурах в диапазоне от -25 до -40°С.
Обсуждение
Точность метода измерения вязкости с помощью DLS оказалась не хуже стандартного вискозиметрического метода. Совпадение значений экспериментальных и литературных данных, представленное на рисунке 1В также свидетельствуют о точности определения вязкости данным методом. Преимуществом использования метода динамического светорассеяния для определения вязкости является его применимость в широких диапазонах температур и давлений. Отмечено его применение для определения вязкости растворов биологических макромолекул [14, 15].
Из представленных на рис. 1Г зависимостей следует, что при понижении температуры до -20°С и ниже вязкость растворов, находящихся под давлением, начинает превышать вязкость растворов без давления. По нашим представлениям, это объясняется начальной стадией процесса образования газогидратов, что приводит к снижению концентрации воды и, соответственно, увеличению концентрации этиленгликоля в растворе. В результате этого вязкость раствора увеличивается. Увеличение вязкости под давлением газов оказалось заметным – на 60% выше контроля при -40°С.
Для использования данного явления в криоконсервации важно оценить, насколько можно понизить концентрацию криопротектора под давлением газа для достижения вязкости такой же, как в контрольном растворе без газа. Концентрация этиленгликоля в растворе, вязкость которого без подачи газа соответствует вязкости 56,4 об.% под давлением газа в диапазоне температур -20 – -30°С составила 60 об.% Таким образом, разница вязкости криозащитного раствора без подачи газа и с подачей газа составила 3,6 об.%. Необходимо отметить, что рост вязкости с повышением концентрации ускоряется. Поэтому концентрация раствора этиленгликоля, при которой вязкость под давлением газов будет близка к вязкости раствора 56,4 об% без давления, может быть уменьшена более чем на 3,6 об.%. По нашим оценкам можно уменьшить концентрацию на значение до 4,5 об.%. С точки зрения борьбы с токсичностью — это значимое уменьшение концентрации. Важно, что вязкость увеличивается при вымораживании воды в газогидрат за счёт увеличения концентрации криопротектора при низких температурах, поэтому данный эффект не должен приводить к повышению токсичности. Равно как и при повышении температуры будет происходить разложение гидрата, повышение содержания воды и разбавление токсического агента.
При исследовании влияния на вязкость витрифицирующих растворов инертных газов, мы ограничились рассмотрением ксенона и криптона. Подбор давлений осуществлялся из соображений обеспечения условий для образования гидрата на экспериментально достижимых температурах (выше -40°С). Однако при меньших давлениях можно добиться снижения температуры гидратообразования. Кроме ксенона и криптона, интерес может представлять аргон. Отличие его в том, что для образования гидратов необходимы либо существенно большие давления, либо существенно меньшие температуры. Интересной также представляется концепция использования смеси гидратообразующих газов.
Проведенное нами экспериментальное исследование позволяет акцентировать внимание на некоторых важных проблемах, которые требуют своего решения в контексте предложенного подхода к оптимизации методов витрификации. Так, например:
- Может ли так случиться, что образующиеся кристаллы газогидратов станут нуклеаторами для кристаллов льда, что сделает невозможной витрификацию растворов? Есть основания полагать, что кристаллические структуры газогидратов и льда принципиально различны, следовательно, газогидрат не может служить нуклеатором льда и наоборот. Артюхов и коллеги [16] смоделировали поведение водного раствора ксенона при различных температурах и давлениях. Симуляция показала, что в присутствии льда в водном растворе нуклеация кристаллов гидратов происходит не на границе вода/лед, а внутри толщи жидкой фазы. Аналогичным образом нуклеация кристаллов льда происходит независимо от газогидрата. Экспериментальным подтверждением этих симуляций являются результаты Нестерова [17], который зафиксировал устойчивое сосуществование кристаллов гидрата пропана и переохлажденной воды во время диссоциации газогидратов пропана. Если бы кристаллы гидрата пропана были эффективными нуклеаторами льда, их устойчивое сосуществование было бы невозможно.
- Какое разрушительное действие окажут образующиеся кристаллы газогидратов? Предположительно, как и в случае с кристаллами льда, основным фактором, влияющим на целостность замораживаемого объекта, будет размер этих кристаллов. Согласно некоторым оценкам, этот размер не должен превышать 300–400 нм [18]. Теоретически, при образовании газогидратов появляется больше возможностей влиять на формирование кристаллов, в частности, на их размер, чем при образовании кристаллов льда. К традиционному выбору температурного режима следует добавить давление, соотношение количества воды и газа, использование газовых смесей и другие факторы. При выборе условий витрификации необходимо избегать кристаллообразования (предположительно массового образования гидратов), подобного тому, что фиксировалось на терминальных стадиях охлаждения в наших экспериментах.
- В данной работе мы рассмотрели вопрос о повышении вязкости раствора криопротектора из-за образования газогидратов. Скорости охлаждения были выбраны низкими (0.5°C/мин), чтобы обеспечить надежное измерение вязкости и продемонстрировать эффекты, которые могут быть использованы для витрификации. При непосредственной реализации процедуры витрификации, очевидно, скорости охлаждения должны быть выше, что позволит процессу формирования кристаллов сместиться в область более низких температур и дополнительно снизить концентрацию криопротектора. Таким образом, вопрос выбора оптимальных скоростей охлаждения, начальных концентраций криопротекторов и самих криопротекторов остается открытым.
Экспериментально обоснованный ответ на эти вопросы является предметом дальнейших исследований.
Заключение
Экспериментально показано увеличение вязкости 56,4 об.% раствора этиленгликоля при действии повышенного давления Xe и Kr. Обоснованы подходы к использованию этого эффекта при разработке методов криоконсервации, основанных на витрификации. Разработан метод регистрации вязкости криозащитных растворов в режиме «реального времени», основанный на динамическом рассеянии света.
Финансирование
Работа выполнена в рамках реализации государственного задания Министерства образования и науки РФ №075-00609-24-01.
Благодарности
Подготовка данной публикации была омрачена смертью нашего соавтора, талантливого инженера Николая Эдуардовича Швирста. Посвящаем эту работу его памяти.
Выражаем искреннюю благодарность сотруднику ИТЭБ РАН Крамаровой Л.И. за помощь при подготовке статьи.
Работа выполнена на оборудовании Сектора оптической микроскопии и спектрофотометрии ЦКП ФИЦ ПНЦБИ РАН.
Список литературы
- Stiles W. On the cause of cold death of plants, Protoplasma 9, 459–468, (1930). DOI:10.1007/BF01943364
- Luyet B. The vitrification of organic colloids and of protoplasm, Biodynamica 1, 1–14, (1937)
- Fahy G.M., Wowk B. Principles of Cryopreservation by Vitrification, in: Methods Molecular Biology: Cryopreservation and Freeze-Drying Protocols, Ed. by W.F. Wolkers & H. Oldenhof (UK, Humana Press, 2015) pp.305-320
- Gonzales F., Luyet B. Resumption of heart beat in chick embryo frozen in liquid nitrogen, Biodynamica 7, 1–5, (1950)
- Fahy G.M., Hirsh A. Prospects for organ preservation by vitrification, in: Organ preservation, basic and applied aspects, Ed. by D.E. Pegg, I.A. Jacobsen, N.A. Halasz (Lancaster, MTP Press, 1982) pp. 399–404.
- Davidson A.F., Glasscock C., McClanahan D.R., Benson J.D., Higgins A.Z. Toxicity Minimized Cryoprotectant Addition and Removal Procedures for Adherent Endothelial Cells, Plos One 10, e0142828, (2015). DOI: 10.1371/journal.pone.0142828
- Best B.P. Cryoprotectant Toxicity: Facts, Issues, and Questions, Rejuvenation Res 18, 422-436, (2015). DOI: 10.1089/rej.2014.1656
- Shishova N. V., Fesenko E. E. (Jr). The Prospects of the Application of Gases and Gas Hydrates in Cryopreservation, Biophysics 60, 782–804, (2015). DOI:10.1134/S0006350915050218
- Istomin V.A., Yakushev V.S. Gas Hydrates at Natural Conditions, (Nedra, Moscow, 1992 (in Russian).
- Dyadin Yu.A., Larionov E.G., Mirinskij D.S., Mikina T.V., Aladko E. Ya, Starostina L.I. Phase Diagram of the Xe–H2O System up to 15 kbar, Journal of Inclusion Phenomena and Molecular Recognition in Chemistry 28, 271–285, (1997). DOI:10.1023/A:1007911123739
- Ohgaki K., Sugahara T., Suzuki M., Jindai H. Phase behavior of xenon hydrate system, Fluid Phase Equilibria 175, 1–6, (2000). DOI:10.1016/S0378-3812(00)00374-5
- Uchida T., Ohmura R., Nagao J., Takeya S., Ebinuma T., Narita H. Viscosity of Aqueous CO2 Solutions Measured by Dynamic Light Scattering, Chem. Eng. Data 48, 1225-1229, (2003). DOI: 10.1021/je034041x
- Ethylene Glycol Product Guide. Доступен по ссылке: https://www.meglobal.biz/wp-content/uploads/2024/03/MEG_Guide_Rev_2024_Wpdf (дата посещения: 07.07.2024).
- He F., Becker G.W., Litowski J.R., Narhi L.O., Brems D.N., Razinkov V.I. High-throughput dynamic light scattering method for measuring viscosity of concentrated protein solutions. Anal Biochem. Apr 1;399(1),141-3, (2010). DOI: 10.1016/j.ab.2009.12.003
- Gilroy EL, Hicks MR, Smith DJ, Rodger A. Viscosity of aqueous DNA solutions determined using dynamic light scattering. Oct 21;136(20),4159-63, (2011). DOI: 10.1039/c1an15475c
- Artyukhov V. I., Pulver A. Y., Peregudov A., Artyuhov I. Can xenon in water inhibit ice growth? Molecular dynamics of phase transitions in water-Xe system, Chem. Phys. 141, 034503, (2014). DOI: 10.1063/1.4887069
- Нестеров А.Н. Кинетика и механизм гидратообразования газов в присутствии поверхностно-активных веществ. Дисс. на соискание доктора химических наук (Институт криосферы Земли СО РАН, Тюмень, 2006).
- Takahashi T., Hirsh A., Erbe E., Williams R.J. Mechanism of cryoprotection by extracellular polymeric solutes, J. 54, 509–518, (1988). DOI: 10.1016/S0006-3495(88)82983-7.
Лицензия
Copyright (c) 2024 Пеньков Н. В. , Крассова Н.Е. , Швирст Н.Э., Фесенко Е.Е. (мл.) (Автор)

Это произведение доступно по лицензии Creative Commons «Attribution-NonCommercial» («Атрибуция — Некоммерческое использование») 4.0 Всемирная.


