Полифосфаты, полифосфатазная активность и устойчивость к стрессам нокаут-мутантов Ppn1 и Ppn2 Saccharomyces cerevisiae
- Организации
-
- 1. Институт биохимии и физиологии микроорганизмов им.Г.К Скрябина РАН ФИЦ "Пущинский научный центр биологических исследований РАН"
- Опубликован:
- 2024-11-07
- Ключевые слова:
- Полифосфатаза, полифосфаты, стресс, PPN1, PPN2, митохондрии, Saccharomyces cerevisia
Аннотация
С использованием коммерчески доступных нокаутных мутантов Saccharomyces cerevisiae (исходный штамм BY4741) по генам PPN1 и PPN2, кодирующим полифосфатазы, показано, что каждая из двух одиночных мутаций приводит к набору схожих физиологических эффектов на стационарной стадии роста на глюкозе: повышению устойчивости к марганцевому и перекисному стрессам и повышению уровня длинноцепочечных полифосфатов. Повышение уровня длинноцепочечных полифосфатов более выражено при нокаут-мутации в гене PPN2. Мы предполагаем, что повышенная устойчивость к стрессу штаммов ∆ppn1 и ∆ppn2 связана с повышением уровня длинноцепочечных полифосфатов. Клетки мутанта ∆ppn1 не отличались по параметрам роста в средах с этанолом или глюкозой, а также по содержанию полифосфатов в митохондриях по сравнению с родительским штаммом. Мутант ∆ppn2 имел более длинную лаг-фазу при переходе к потреблению этанола. Полученные данные подтверждают представление о том, что полифосфатазы Ppn1 и Ppn2 ответственны за регуляцию длины цепи полифосфатов, а полифосфаты и их обмен важны для стрессовой адаптации дрожжей.
Полный текст
Введение
Неорганические полифосфаты (polyP), линейные полимеры ортофосфорной кислоты, присутствуют во всех живых клетках от архей до млекопитающих. В настоящее время сложилась концепция участия polyP и ферментов метаболизма polyP в различных процессах, регулирующих жизнедеятельность эукариот [1–3]. Дрожжи могут накапливать большое количество polyP [4]. Функции этих полимеров в клетках дрожжей простираются от фосфатного и энергетического резерва [4] до ключевой роли в регуляции клеточного цикла [5] и модификации активности ферментов [6–8]. PolyP влияют на физиологию клетки посредством неферментативного полифосфорилирования остатков лизина в белках, включая ДНК-топоизомеразу I, Nsr1 и факторы биогенеза рибосом [7]. PolyP дрожжей участвуют в подавлении экспрессии генов, предположительно в пути субтеломерного ингибирования TORC2 [9].
Одним из подходов к пониманию путей участия polyP в различных клеточных процессах является изучение физиологических особенностей нокаут-мутантов в генах, кодирующих ферменты, метаболизирующие polyP. У Saccharomyces cerevisiae идентифицированы и охарактеризованы четыре полифосфатазы [10-14]. Среди них Ppn1 и Ppn2 оказывают наибольшее влияние на уровень и длину цепи polyP [10-13]. Как Ppn1, так и Ppn2 проявляют эндополифосфатазную активность (полифосфатдеполимераза, EC 3.6.1.10.) и расщепляют длинные цепи polyP на более короткие:
PolyPn+H2O→polyPm (m<n)
Ppn1 также проявляет экзополифосфатазную активность (полифосфатфосфогидролаза, EC 3.6.1.11) и отщепляет ортофосфат от конца цепи polyP:
PolyPn+H2O→PolyPn-1+Pi
Кроме того, Ppn1 отщепляет терминальный фосфат от нуклеозид-5’-тетрафосфата и дезоксинуклеозидтрифосфата [14]. Как Ppn1, так и Ppn2 способны отщеплять polyP от polyP-лизин-фосфорилированных белков [7]. Наличие этих активностей расширяет вовлечение данных полифосфатаз в регуляторные процессы. Ферменты Ppn1 и Ppn2 различаются по клеточной локализации: Ppn2 локализуется в вакуолярной мембране [13]; Ppn1 также локализуется в основном в вакуолях, но был обнаружен в цитоплазме при избытке фосфата [15] и, по-видимому, отвечает за экзополифосфатазную активность в митохондриальной мембране и ядре [16].
Эффекты нокаут-мутаций в генах PPN1 и PPN2 на метаболизм polyP различались в зависимости от стадии роста и условий культивирования. Увеличение уровня polyP и длины цепи наблюдали у мутанта ∆ppn1, культивируемого в минимальной среде, содержащей 2% глюкозы, 0.5% (NH4)2SO4, 7.35 мМ фосфата, микроэлементы, соли и витамины [11]. Уровень polyP увеличился в митохондриях и вакуолях мутанта Δppn1, а длина цепи polyP увеличилась в митохондриях, вакуолях и цитоплазме при культивировании дрожжевых клеток в богатой комплексной среде YPD [16]. В тоже время, уровни polyP в мутантах Δppn1, Δppn2 и Δppn1Δppn2 не изменились по сравнению с родительским штаммом в клетках, культивируемых в минимальной среде Sc [13]. Обе мутации привели к увеличению длины цепи polyP [7, 13]. Был сделан вывод, что полифосфатазы Ppn1 и Ppn2 вносят ключевой вклад в регуляцию содержания и длины цепи polyP в клетках S. cerevisiae [7, 13]. Кроме того, были обнаружены другие эффекты нокаута гена PPN1. Мутантный штамм Δppn1 имел пониженную жизнеспособность на стационарной стадии роста [11] и не мог расти на лактате и этаноле [17]. У двойного мутанта Δppn1Δppx1 время репликации ДНК увеличилось вдвое [5]. Различия в генетических конструкциях мутантов и в условиях культивирования затрудняют сравнение литературных данных о влиянии нокаут-мутаций генов PPN1 и PPN2 на обмен polyP и другие физиологические свойства дрожжевых клеток.
Поэтому целью данной работы было изучение влияния нокаут мутаций Δppn1 и Δppn2 с использованием стандартных коммерческих мутантов S. cerevisiae на следующие физиологические свойства: (i) рост на средах, содержащих глюкозу и этанол, (ii) содержание и длину цепи различных фракций polyP, (iii) активность полифосфатазы в субклеточных фракциях, включая митохондрии, и (iiii) устойчивость к стрессам, вызванным перекисью и токсическими концентрациями марганца и кадмия.
Материалы и методы
Штамм дикого типа (WT) S. cerevisiae BY4741 (MATa his3Δ1 leu2Δ0 lys2Δ0 ura3Δ0) и мутантные штаммы, полученные из BY4741 (∆ppn1 и ∆ppn2), были получены из коллекции Dharmacon (https://horizondiscovery.com/en/non-mammalian-research-tools/products/yeast-knockout). Культуры дрожжей поддерживали на агаризованной среде YPD, содержащей 2% пептона (Pronadisa, Испания), 1% дрожжевого экстракта (Pronadisa, Испания), 2% глюкозы и 2% агара. Инокулят выращивался в жидкой среде YPD. Клетки для экспериментов культивировали в среде YPD и среде YPEt, содержащей 1% этанола вместо глюкозы. Инокулят вносили в среду до оптической плотности ~0,065. Штаммы культивировали при температуре 29°С на качалке в колбах с 200 мл среды и скоростью перемешивания 145 об/мин в случае среды YPD и в колбах с 50 мл и скоростью перемешивания 250 об/мин в случае среды YPEt. Для построения кривых роста штаммов через определенные промежутки времени отбирали аликвоты культур и измеряли поглощение при λ=600 нм в кювете 3.07 мм на фотометре КФК-3 (ЗОМЗ, Россия). Биомассу собирали на стационарной стадии роста (24 ч для YPD и 60 ч для YPEt) центрифугированием в течение 10 мин при 4000 g, трижды промывали холодной (4°С) дистиллированной водой, взвешивали, замораживали при -20°С и использовали для анализа polyP.
Пять фракций polyP (кислоторастворимая polyP1, солерастворимая polyP2, щелочечерастворимые polyP3 и polyP4, кислотонерастворимая polyP5) экстрагировали согласно [18]. Фосфат (Pi) определяли колориметрическим методом [19]. Количество polyP нормировали по сырому весу образцов биомассы, стандартизированных центрифугированием при 5000 g в течение 15 мин.
Активность экзополифосфатазы и эндополифосфатазы измеряли в бесклеточном экстракте и суммарной мембранной фракции. Дрожжевые клетки собирали и дважды промывали дистиллированной водой при 5000 g в течение 10 мин; сферопласты получали, как описано [14]. Сферопласты лизировали в стеклянном гомогенизаторе Поттера в 0.1 М сорбите, 25 мМ Трис-HCl, pH 7.2, дополненном 0.5 мМ фенилметилсульфонилфторида (Sigma-Aldrich, США) и центрифугировали при 5000 g в течение 10 мин. Супернатант собирали и центрифугировали при 15000 g в течение 60 мин. Супернатанты представляли собой бесклеточные экстракты. Осадки (грубая мембранная фракция) ресуспендировали в 25 мМ Трис-HCl, pH 7.2.
Активность экзополифосфатазы определяли при 30°C по скорости образования Pi, определяемого колориметрически [14]. Инкубационная среда содержала 50 мМ Трис-HCl, pH 7.2, 2 мМ MgSO4, 200 мМ NH4Cl и 2.5 мМ polyP со средней длиной цепи 208 фосфатных остатков (polyP208) (Monsanto, США). Количество фермента, образующего 1 мкмоль фосфата за 1 мин, принимали за единицу активности (Е). Активность эндополифосфатазы анализировали по уменьшению длины цепи polyP208. Инкубационная среда содержала 50 мМ Трис-HCl, pH 7.2, 200 мМ NH4Cl, 2 мМ MgSO4, 9 мМ (по фосфору) polyP208 и образцы бесклеточного экстракта или грубой мембранной фракции. Время инкубации составило 30 мин при 30°. Реакцию останавливали добавлением HClO4 до концентрации 0.5 М. Дальнейшую подготовку образцов и электрофорез в 30% ПААГ с 7 М мочевиной проводили, как описано [14].
БСА использовали в качестве стандарта для анализа белка с реагентом Брэдфорда (Thermo Fisher, США) в соответствии с инструкциями производителя.
Митохондрии выделяли методом дифференциального центрифугирования согласно [20] с модификациями. Для получения митохондрий из клеток, выращенных на глюкозе, клетки выращивали в среде YPD в течение 24 ч. Для получения митохондрий из клеток, культивированных на этаноле, клетки предварительно выращивали в среде YPD (0.5% дрожжевого экстракта, 1% пептона, 1% глюкозы) в колбах с 200 мл среды на шейкере при 145 об/мин в течение 24 ч, осаждали, промывали водой и переносили в среду YPEth (0.5% дрожжевого экстракта, 1% пептона, 1% этанола) в колбах с 50 мл среды в количестве 0.5 г сырой биомассы на колбу. Культивирование проводили в течение 10 ч при 29°С и 250 об/мин. Сферопласты получали, как описано ранее [16]. В случае клеток, выращенных на глюкозе, сферопласты лизировали в стеклянном гомогенизаторе Поттера-Эльвехьема в буфере, содержащем 20 мМ Трис-HCl, pH 6.8, 1 мМ PMSF, 1 мМ EDTA, 4 мМ MgSO4, 0.02% бычьего сывороточного альбумина, 0.05% конканавалина А. После этого при перемешивании быстро добавляли равный объем того же буфера, но с 1.2 М сорбита. Гомогенат центрифугировали при 3000 g в течение 10 мин. Полученный супернатант центрифугировали при 10000 g в течение 10 мин. Осадок гомогенизировали тефлоновым пестиком в 0.6 М сорбите с тем же буфером в течение 1 мин и центрифугировали при 2500 g в течение 10 мин. Митохондрии из супернатанта, полученного после второго низкоскоростного центрифугирования, осаждали при 10000 g в течение 10 мин.
В случае клеток, выращенных на этаноле, сферопласты разрушали в буфере, уже содержащем 0.6 М сорбита и без второго этапа гомогенизации.
Активность АТФазы определяли по скорости высвобождения Pi при 30 °C в течение 30 мин в 1 мл реакционной смеси, содержащей 1 мМ MgSO4 и 1 мМ АТФ в 50 мМ Трис-HCl при pH 8.5 в присутствии и в отсутствие 5 мМ NaN3. Pi определяли, как описано ранее [14].
Активность экзополифосфатазы определяли по скорости высвобождения Pi при 30 °C в течение 30 мин в 1 мл реакционной смеси, содержащей 2.5 мМ MgSO4 и 1 мМ polyP188 (Monsanto, США) в 50 мМ Tris-HCl при pH 7.2.
Для выделения polyP препараты митохондрий обрабатывали при 0 °C 1 М HClO4 в течение 15 мин при перемешивании и центрифугировали при 10000 g в течение 10 мин. Содержание Pi и фосфор polyP после обработки 1 М HCl при 100 ºC в течение 10 мин измеряли в супернатанте, как описано выше.
Для определения чувствительности к перекиси и ионам тяжелых металлов образцы клеток дрожжей, нормализованные по концентрации клеток (0.5 · 107 клеток/мл), добавляли в лунки стерильных планшетов, содержащих среду YPD и различные концентрации Cd(CH3COO)2 × 2H2O, MnSO4 или перекиси водорода, культивировали в течение 24 ч и измеряли оптическую плотность культуры при 594 нм с помощью фотометра ЭФОС (Сапфир, Россия). Исходную концентрацию клеток определяли с помощью подсчета в стандартной камере Горяева.
Эксперименты были повторены трижды, и результаты представлены в виде среднего значения со стандартным отклонением (Excel). Статистическую значимость оценивали относительно данных для родительского штамма wt с помощью t-критерия Стьюдента, используя стандартную программу Excel. Эксперименты с электрофорезом были повторены дважды, и представлены типичные картины.
Результаты
3.1.Рост на глюкозе и этаноле
Родительский штамм (wt) и мутантные штаммы культивировали в средах, содержавших 3 мМ Pi. При культивировании штаммов ∆ppn1 и ∆ppn2 в среде YPD не наблюдалось дефектов роста (Рис. 1). Что касается культивирования в среде YPEth с 1% этанола, штаммы wt и ∆ppn1 были схожи по росту, в то время как ∆ppn2 имел более длинную лаг-фазу (Рис. 1).
3.2.Содержание и длина цепи polyP
Мы сравнили содержание polyP разных фракций в клетках штаммов wt и мутантных штаммов, выращенных на глюкозе и этаноле в клетках стационарной стадии (рис. 2А). Не было обнаружено статистически значимых различий в содержании polyP в разных фракциях между клетками wt и ∆ppn1 при культивировании на средах, как содержащих глюкозу, так и этанол (рис. 2А). В клетках мутанта ∆ppn2 содержание относительно короткоцепочечных polyР1 и polyР2 снижалось, в то время как содержание более длинноцепочечных polyР3 и polyР5 увеличивалось независимо от используемого источника углерода (рис. 2А). Мы также оценили длину цепи polyP фракций с наибольшим содержанием polyP методом электрофореза с использованием препаратов polyP, полученных из клеток, выращенных на глюкозе (рис. 2Б).
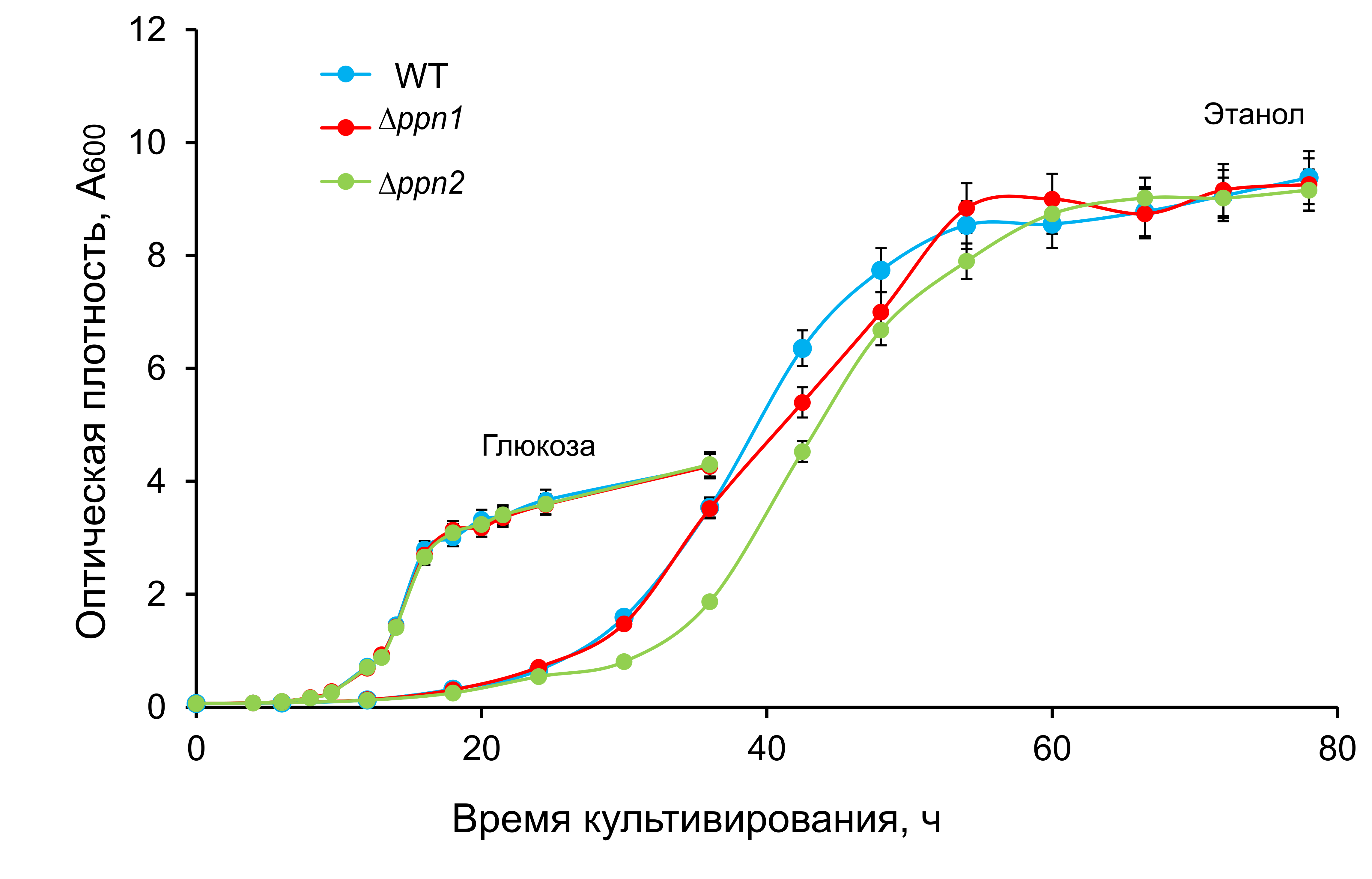
Рисунок 1. Кривые роста штаммов S. cerevisiae в средах YPD (глюкоза) и YPEth (этанол)
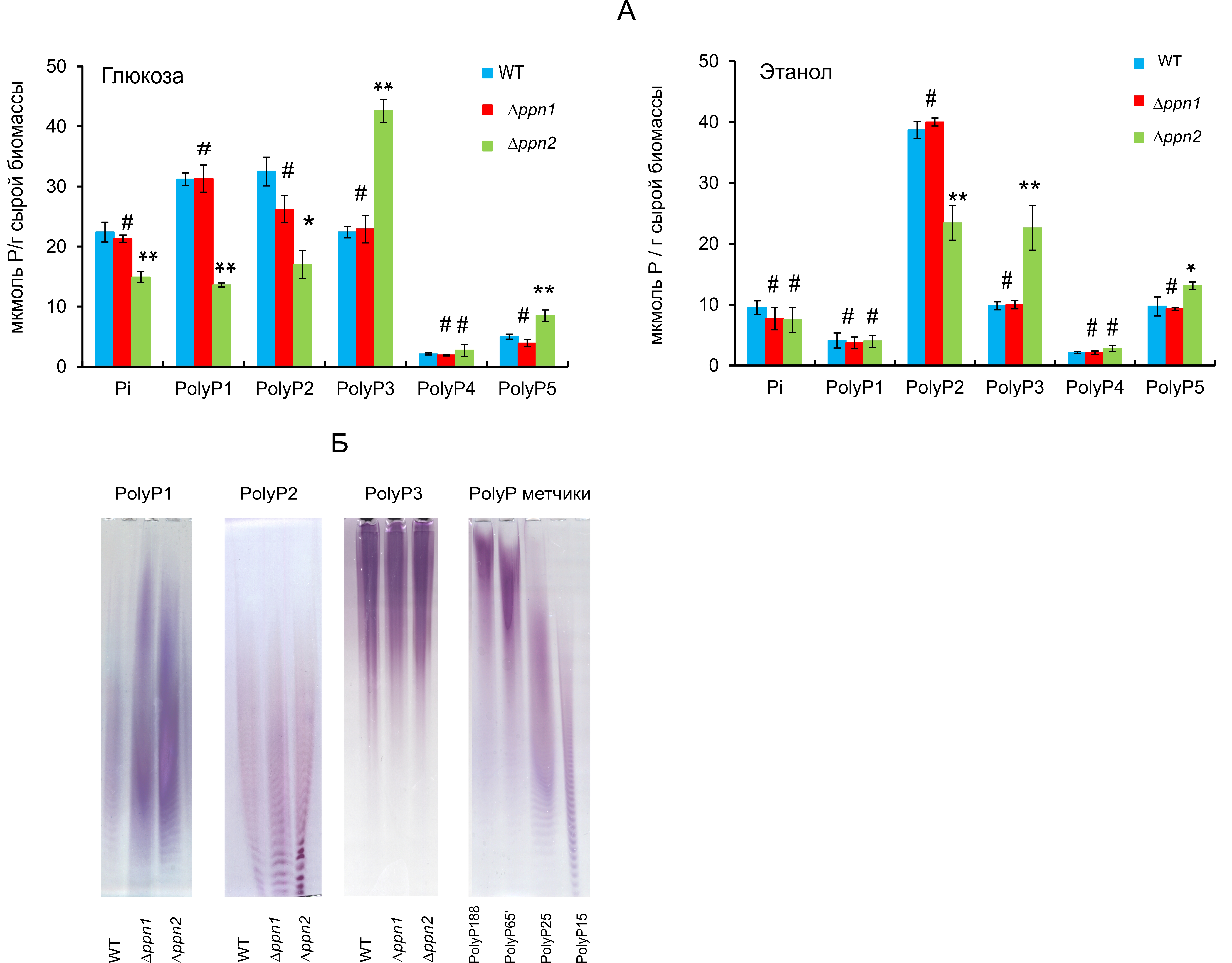
Рисунок 2. A - Cодержание Pi и polyP различных фракций в клетках трех штаммов S. cerevisiae, выращенных до стационарной стадии роста на средах c глюкозой или этанолом. Статистическую значимость оценивали относительно данных для родительского штамма wt с помощью t-критерия Стьюдента, используя стандартную программу Excel:* p < 0.01, ** p < 0.001, #- разница статистически незначима.
Б – электрофореграмма препаратов фракций polyP1, polyP2 и polyP3, полученных из клеток, выращенных в среде с глюкозой, polyP15-188 - препараты коммерческих полифосфатов со средними длинами цепи от 15 до 188 фосфатных остатков (Sigma-Aldrich, США).
Длины цепей polyР2 и polyР3 были схожи в препаратах, полученных из всех трех штаммов. Длина цепи polyР1 увеличилась как в случае штаммов ∆ppn1, так и ∆ppn2. Увеличение доли длинноцепочечных polyP было наиболее выражено в клетках штамма ∆ppn2.
3.3.Полифосфатазная активность в субклеточных фракциях
Мы сравнили полифосфатазные активности в препаратах растворимой фракции (бесклеточного экстракта) и грубой мембранной фракции для трех исследованных штаммов.
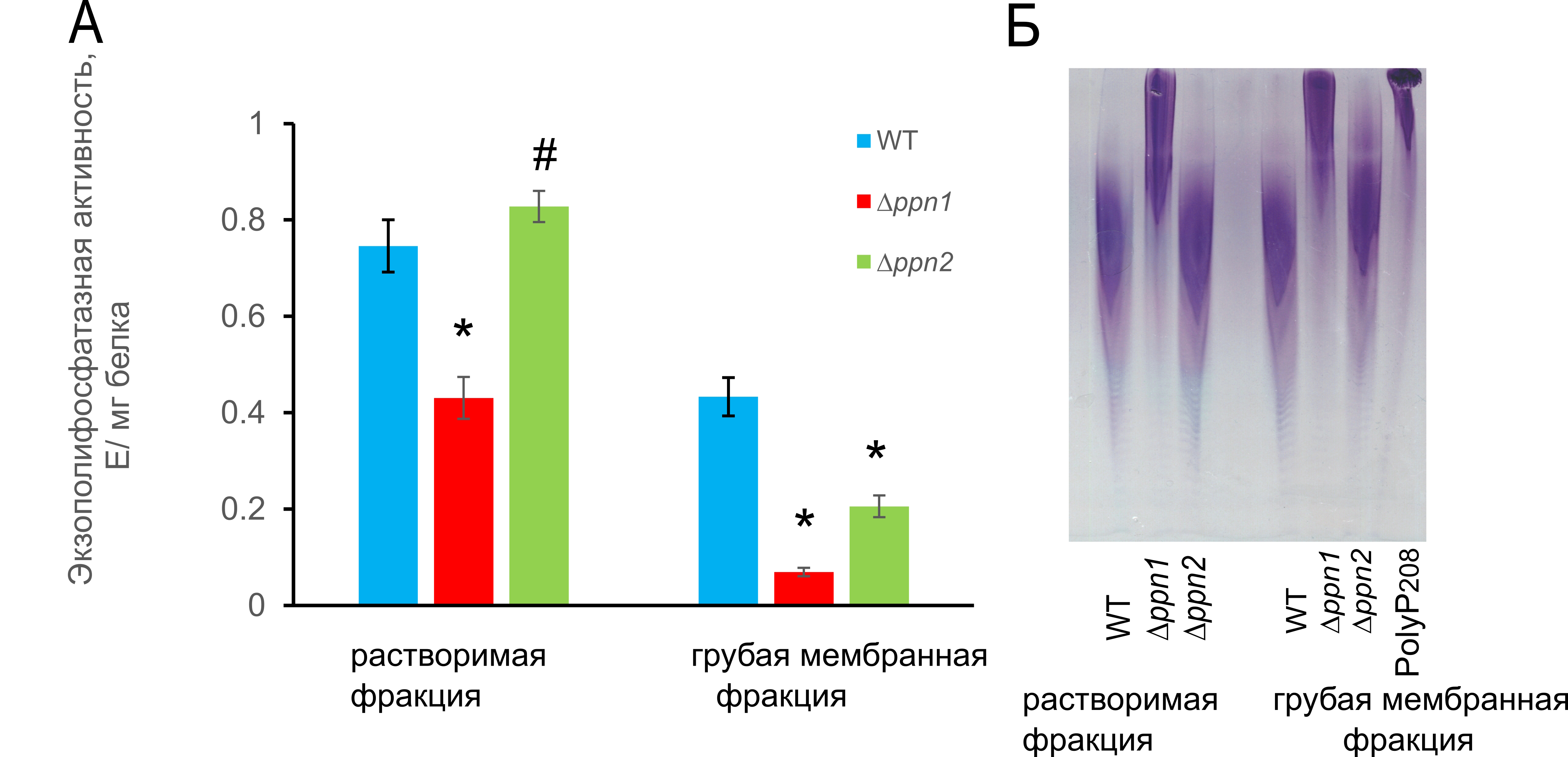
Рисунок 3. A - Экзополифосфатазные активности в растворимой и грубой мембранной фракциях с субстратом polyP208. Статистическую значимость оценивали относительно данных для родительского штамма wt с помощью t-критерия Стьюдента, используя стандартную программу Excel:* p < 0.001, #- разница статистически незначима. Б – Эндополифосфатазная активность (электрофореграммы polyP208 после инкубации с препаратами растворимой и грубой мембранной фракций. PolyP208 - контрольная инкубация полифосфатов с длиной цепи около 208 фосфатных остатков без добавления исследуемых образцов
Как и ожидалось, в суммарной мембранной фракции мутанта ∆ppn1 было значительное снижение как экзо-, так и эндополифосфатазной активности. В этой фракции мутанта ∆ppn2 также было снижение эндополифосфатазной активности (рис. 3Б). Эти данные согласуются с информацией о преимущественной локализации Ppn1 в вакуолярных и митохондриальных мембранах и в ядрах [13,16]. Неожиданно фракция бесклеточного экстракта, полученная из клеток штамма ∆ppn1, также продемонстрировала значительное снижение эндо- и экзополифосфатазной активности (Рис. 3A и Б). Этот факт предполагает значительный уровень Ppn1 в цитоплазме штамма wt. Это, по-видимому, является характерной особенностью штамма BY4741. Обычно уровень Ppn1 в цитоплазме низкий [15]. Метод получения бесклеточного экстракта [16], использованный в настоящей работе, не приводит к примесям клеточных органелл. Ранее значительное увеличение уровня Ppn1 в цитоплазме наблюдалось у мутанта, лишенного полифосфатазы Ppx1 [11], а также у дикого штамма S. cerevisiae в условиях сверхнакопления polyP [15] или при стрессе, нарушающем репликацию ДНК [21]. Что касается мутанта ∆ppn2, то как экзо-, так и эндополифосфатазная активность не изменялись в бесклеточном экстракте, но снижались в мембранной фракции (Рис. 3). Это согласуется с данными о локализации Ppn2 в вакуолярной мембране [13]. Ppn2 не проявляет существенной экзополифосфатазной активности in vitro [14]. По-видимому, сниженная способность высвобождать Pi из polyP в грубой мембранной фракции мутанта ∆ppn2 обусловлена тем, что фрагментация polyP эндополифосфатазой Ppn2 в той же фракции из штамма wt облегчает последующий гидролиз другими ферментами, например пирофосфатазами. Снижение активности полифосфатазы в обеих субклеточных фракциях более выражено для мутанта ∆ppn1 по сравнению с мутантом ∆ppn2. Это не согласуется с тем фактом, что увеличение содержания длинноцепочечных polyP более выражено в клетках штамма ∆ppn2. Отметим, что условия в клетке могут значительно отличаться от условий in vitro. Так, значение pH внутри вакуолей находится в кислом диапазоне, тогда как оптимальное значение pH для обеих полифосфатаз находится в нейтральном диапазоне. Кроме того, у дрожжевых клеток могут быть и другие, неизвестные в настоящее время пути регуляции гидролиза polyP полифосфатазами, часто локализованными вместе с polyP.
3.4.Полифосфатазная активность и polyP в митохондриях
Неспособность мутанта ∆ppn1 CRN [11] расти на неферментируемых субстратах, таких как лактат и этанол, была обнаружена много лет назад [17]. Его митохондрии были дефектны по дыхательным функциям, не обладали экзополифосфатазной активностью и обладали удвоенным уровнем polyP в митохондриях [17]. Мутант ∆ppn1, использованный в этом исследовании, не имел дефектов роста при культивировании в среде с этанолом (Рис. 1). Чтобы понять различия между этими двумя мутантами ∆ppn1 разного происхождения, мы получили препараты митохондирий из штаммов wt и ∆ppn1. АТФазная активность препаратов была высокочувствительна к специфическому ингибитору митохондриальной АТФазы NaN3 (Таблица 1), что свидетельствует о достаточной чистоте препаратов от примесей вакуолей и цитоплазматических мембран. Как и в случае ранее изученной пары штаммов [17], активность полифосфатазы в митохондриальном препарате штамма ∆ppn1 была незначительной (Таблица 1). Однако содержание polyP в мутантных митохондриях лишь слабо увеличивалось при росте на глюкозе (Таблица 2). Что касается препарата митохондрий из клеток, выращенных на этаноле, то и в штамме wt, и в штамме ∆ppn1 наблюдали значительное снижение содержания polyP (Таблица 2), как и ранее наблюдали для клеток дикого типа [22]. Уровень polyP в клетках мутанта ∆ppn1 снижался при культивировании на этаноле, несмотря на низкий уровень активности полифосфатазы. По-видимому, существуют иные способы регуляции уровня polyP в митохондриях, которые не реализованы в ранее использованном штамме CRN.
Таблица 1. АТФазная и полифосфатазная активности в препаратах митохондрий штаммов wt и ∆ppn1 S. cerevisiae
|
Штамм |
ATФаза, Е/мг белка |
ATPаза, активность в присутствии NaN3, % от контроля |
Полифосфатаза, Е/мг белка |
|||
|
глюкоза |
этанол |
глюкоза |
этанол |
Глюкоза |
этанол |
|
|
wt |
0.53 ±0.01 |
0.51±0.048 |
20 |
13 |
0.58 ±0.02 |
0.055 ±0.001 |
|
∆ppn1 |
0.38 ±0.004 |
0.44 ±0.025 |
19 |
15 |
< 0.01 |
0.019 ±0.001 |
Таблица 2. Pi и polyP (мкмоль P/мг белка) в препаратах митохондрий, полученных их клеток штаммов wt and ∆ppn1.
|
Штамм |
Pi |
Кислоторастворимые polyP |
Кислотонерастворимые polyP |
|||
|
глюкоза |
этанол |
глюкоза |
этанол |
глюкоза |
этанол |
|
|
wt |
0.14 ±0.02 |
0.069 ±0.001 |
0.31 ±0.06 |
0.12 ±0.01 |
0.52 ±0.003 |
0.34 ±0.004 |
|
∆ppn1 |
0.17 ±0.01 |
0.037 ±0.001 |
0.38 ±0.06 |
0.11 ±0.008 |
0.68 ±0.01 |
0.37 ±0.007 |
3.5.Устойчивость к стрессам
Поскольку polyP участвует в механизмах устойчивости к ионам тяжелых металлов [4] и перекиси [23], штаммы сравнивали по устойчивости к Cd2+, Mn2+ и перекиси. Устойчивость к Cd2+ была одинаковой для всех протестированных штаммов (Рис. 4А).
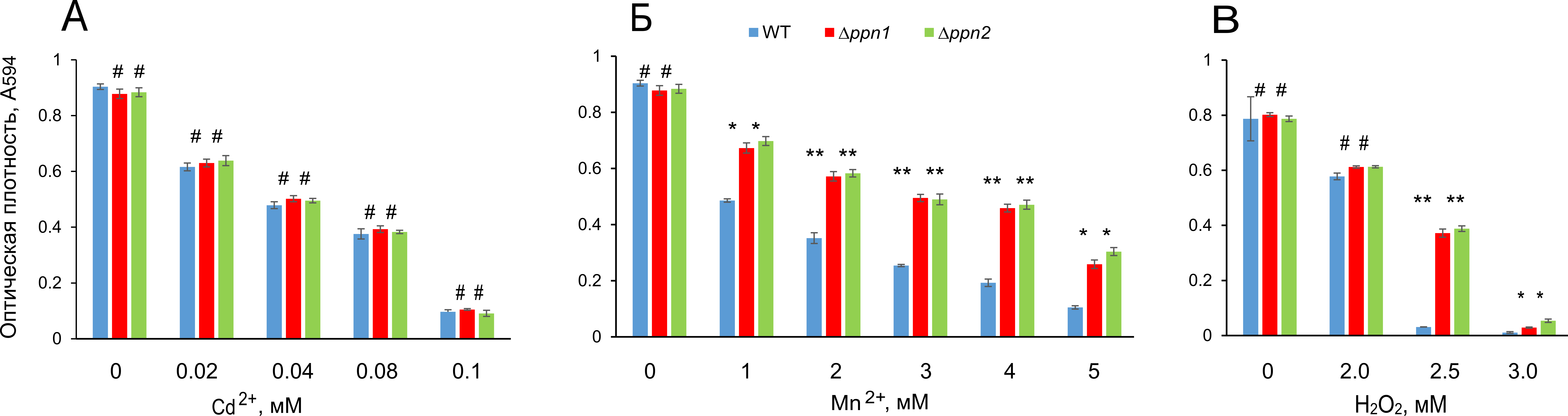
Рисунок 4. Влияние Cd2+, Mn2+ и перекиси водорода на рост штаммов wt, Δppn1 и Δppn2 S. cerevisiae. Эксперименты проводили в четырех повторностях. Статистическую значимость оценивали относительно данных для родительского штамма wt с помощью t-критерия Стьюдента, используя стандартную программу Excel: ** p < 10-4, * p < 0,001, # - разница статистически незначима.
Оба штамма ∆ppn1 и ∆ppn2 продемонстрировали схожее увеличение устойчивости к Mn2+ (Рис. 4Б) и перекиси водорода (Рис. 4В). Мы полагаем, что эти изменения связаны с более высоким содержанием длинноцепочечных polyP.
Обсуждение
В данной работе показано, что нокаут-мутации в генах PPN1 и PPN2 приводят к совокупности физиологических эффектов, наблюдаемых на стационарной стадии роста на глюкозе:
- Снижение активности полифосфатазы в субклеточных фракциях, содержащей мембранные структуры и органеллы, включая митохондриальную фракцию;
- Увеличение содержания высокомолекулярных polyP, что более выражено у нокаут-мутанта по гену PPN2;
- Повышение устойчивости к марганцевому и перекисному стрессу.
Можно предположить, что уровень polyP в нормальных условиях культивирования определяется в первую очередь их синтезом, который осуществляется комплексом VTC [24]. Полифосфатазы с эндополифосфатазной активностью, такие как Ppn1 и Ppn2, участвуют в уменьшении длины цепи polyP, что, вероятно, необходимо для распределения полученного polyP по органеллам и компартментам, таким как митохондрии, ядро и цитоплазма. Хотя многие авторы считают вакуоли основными компартментами, содержащими polyP в клетках дрожжей [13], было показано, что polyP присутствуют в ядре, цитоплазме и митохондриях [16]. Удлинение polyP у мутантов ∆ppn1 и ∆ppn2, вероятно, влияет на различные клеточные процессы, включая регуляцию активности ферментов, а также способность связывать ионы токсичных металлов. Данные о влиянии этих мутаций на общее количество polyP в клетке неоднозначны. Так, в одной из публикаций сообщается, что содержание polyP увеличилось в клетках мутанта ∆ppn1, но не ∆ppn2 [26], тогда как другие авторы [7] показали, что даже у мутанта ∆ppn1ppn2ppx1ddp1 общее содержание polyP мало отличалось от такового в клетках дикого типа [7]. В нашем случае суммарное содержание polyP у мутантов не отличалось от родительского штамма. Основной интерес представляет увеличение содержания длинноцепочечных polyP, которое отмечено как в настоящей работе, так и в работах других авторов [7, 26]. На данный момент не представляется возможным проследить прямую взаимосвязь между этим изменением и многочисленными плейотропными эффектами мутаций ∆ppn1 и ∆ppn2. Недавно выявлены новые эффекты этих мутаций: у обоих мутантов снижена репликативная продолжительность жизни [26], клетки мутанта Δppn1Δppx1Candida albicans характеризуются повышенной чувствительностью к стрессам и псевдогифальной морфологией [27]. Можно предполагать, что множественные эффекты этих мутаций могут быть связаны как с регулирующей ролью polyP, способных непосредственно взаимодействовать с определенными участками ДНК [9], так и со способностью Ppn1 и Ppn2 участвовать в отщеплении polyP от лизин-полифосфорилированных белков [7] или гидролизовать различные сигнальные молекулы [14].
Результаты данной работы показывают, что один из ранее обнаруженных нами эффектов мутации Δppn1, а именно дефект развития митохондрий и неспособность расти на неферментируемых источниках углерода [17] у мутанта CRN по гену PPN1, сконструированному Sethuraman и др. [11], не воспроизводится в использованном нами коммерчески доступном штамме Δppn1. Данные по определению полифосфатаpной активности свидетельствуют о том, что в данном штамме действительно отсутствует полифосфатаза Ppn1. Cледовательно, наша предыдущая гипотеза о роли Ppn1 в регуляции уровня polyP и образовании митохондрий из промитохондрий [17] неверна, а дефекты функции митохондрий, наблюдаемые в мутантном штамме CRN не связанны с отсутствием Ppn1, а вероятнее всего объясняются повреждением других генов при конструировании штамма. Обратим внимание, что генотип родительского штамма BY4741 (MATahis3Δ1 leu2Δ0 lys2Δ0 ura3Δ0) отличается от генотипа родительского штамма CRY (MATaade2 his3 leu2 trp1 ura3), который был использован авторами [11] для конструирования мутанта CRN ∆ppn1 (MATa ade2 his3 ura3 ppn1∆::CgTRP1).
Мутанты, лишенные полифосфатаз Ppn1 или Ppn2, показали как увеличение длины цепи polyP, так и увеличение устойчивости к марганцу и перекиси. Штамм со сверхэкспрессией Ppn1 также показал более высокую устойчивость к обоим типам стресса, в то время как штамм со сверхэкспрессией Ppn2 показал более высокую устойчивость к перекиси [25]. По-видимому, пути, ведущие к этому увеличению, различны при нокаут-мутациях и сверхэкспрессии этих генов. У нокаут-мутантов увеличение устойчивости к марганцу можно объяснить повышенным уровнем высокомолекулярных polyP и улучшенным связыванием этих ионов, тогда при сверхэкспрессии полифосфатаз, когда уровень высокомолекулярных polyP снижается, следует предполагать более сложные опосредованные пути, в том числе связанные с влиянием на уровень таких вторичных сигнальных молекул, как инозитополифосфаты, чей обмен тесно связан с обменом polyP [12].
Вклад авторов
Трилисенко Л.В., Ледова Л.А., Рязанова Л.П., Кулаковская Е.В., Томашевский А.А. – выполнение и анализ экспериментов, Кулаковская Т.В. – написание рукописи. Все авторы прочитали и согласились с опубликованной версией рукописи.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
- Rao N. N., Gómez-García M. R. and Kornberg A. Inorganic polyphosphate: Essential for growth and survival. Ann Rev Biochem., 78, 605–647 (2009).
- Kus F., Smolenski R. T. and Tomczyk M. Inorganic polyphosphate-regulator of cellular metabolism in homeostasis and disease. Biomedicines, 10 (4), 913 (2022). DOI: 10.3390/biomedicines10040913.
- McCarthy L. and Downey M. The emerging landscape of eukaryotic polyphosphatases. FEBS Lett., 597 (11), 1447–1461 (2023). DOI: 10.1002/1873-3468.14584.
- Kulaev I. S., Vagabov V. M. and Kulakovskaya T. V. The biochemistry of inorganic polyphosphates, (New York USA, Wiley, 2004).
- Bru S., Martínez-Laínez J. M., Hernández-Ortega S., Quandt E., Torres-Torronteras J., Martí R., Canadell D., Ariño J., Sharma S., Jiménez J. and Clotet J. Polyphosphate is involved in cell cycle progression and genomic stability in Saccharomyces cerevisiae. Mol Microbiol., 101 (3), 367–380 (2016). DOI: 10.1111/mmi.13396.
- Kalebina T. S., Egorov S. N., Arbatskii N. P., Bezsonov E. E., Gorkovskii A..A. and Kulaev I. S. The role of high-molecular-weight polyphosphates in activation of glucan transferase Bgl2p from Saccharomyces cerevisiae cell wall. Dokl Biochem Biophys., 420, 142–145 (2008). DOI: 10.1134/s1607672908030125.
- Azevedo C., Desfougères Y., Jiramongkol Y., Partington H., Trakansuebkul S., Singh J., Steck N., Jessen H. J. and Saiardi A. Development of a yeast model to study the contribution of vacuolar polyphosphate metabolism to lysine polyphosphorylation. J Biol Chem,. 295 (6), 1439–1451 (2020). DOI: 10.1074/jbc.RA119.011680.
- McCarthy L., Bentley-DeSousa A., Denoncourt A., Tseng Y .C., Gabriel M. and Downey M. Proteins required for vacuolar function are targets of lysine polyphosphorylation in yeast. FEBS Lett., 594 (1), 21–30 (2020). DOI: 10.1002/1873-3468.13588.
- Sanchez A. M., Garg A., Schwer B. and Shuman S. Inorganic polyphosphate abets silencing of a sub-telomeric gene cluster in fission yeast. Micro Publ Biol., 3; (2023) DOI: 10.17912/micropub.biology.000744. DOI: 10.17912/micropub.biology.000744.
- Wurst H., Shiba T. and Kornberg A. The gene for a major exopolyphosphatase of Saccharomyces cerevisiae. J Bacteriol., 177: 898–906 (1995). DOI: 1128/jb.177.4.898-906.1995.
- Sethuraman A., Rao N. N., and Kornberg A. The endopolyphosphatase gene: essential in Saccharomyces cerevisiae, Proc Natl Acad Sci USA, 98 (15), 8542–8547 (2001). DOI: 10.1073/pnas.151269398.
- Lonetti A., Szijgyarto Z., Bosch D., Loss O., Azevedo C. and Saiardi A. Identification of an evolutionarily conserved family of inorganic polyphosphate endopolyphosphatases, J Biol Chem., 286, 31966–31974 (2011). DOI: 10.1074/jbc.M111.266320.
- Gerasimaitė R. and Mayer A. Ppn2, a novel Zn2+-dependent polyphosphatase in the acidocalcisome-like yeast vacuole. J Cell Sci., 130 (9), 1625–1636 (2017). DOI:1242/jcs.201061.
- Andreeva N., Ledova L., Ryazanova L., Tomashevsky A., Kulakovskaya T. and Eldarov M. Ppn2 endopolyphosphatase overexpressed in Saccharomyces cerevisiae: comparison with Ppn1, Ppx1, and Ddp1 polyphosphatases. Biochimie, 163, 101–107 (2019). DOI: 10.1016/j.biochi.2019.06.001.
- Andreeva N. A., Kulakovskaya T. V., and Kulaev I. S. High molecular mass exopolyphosphatase from the cytosol of the yeast Saccharomyces cerevisiae is encoded by the PPN1 Biochemistry (Moscow), 71 (9),975–977 (2006). DOI: 10.1134/s0006297906090045.
- Lichko L., Kulakovskaya T., Pestov N. and Kulaev I. Inorganic polyphosphates and exopolyphosphatases in cell compartments of the yeast Saccharomyces cerevisiae under inactivation of PPX1 and PPN1 Biosci Rep., 26 (1), 45–54 (2006). DOI: 10.1007/s10540-006-9003-2.
- Pestov N. A., Kulakovskaya T. V. and Kulaev I. S. Effects of inactivation of the PPN1 gene on exopolyphosphatases, inorganic polyphosphates and function of mitochondria in the yeast Saccharomyces cerevisiae. FEMS Yeast Res., 5 (9), 823–828 (2005). DOI: 10.1016/j.femsyr.2005.03.002.
- Vagabov V. M., Trilisenko L. V. and Kulaev I. S. Dependence of inorganic polyphosphate chain length on the orthophosphate content in the culture medium of the yeast Saccharomyces cerevisiae. Biochemistry (Moscow), 65, 349–355 (2000).
- Heinonen J. K. and Lahti R. J. A new and convenient colorimetric determination of inorganic orthophosphate and its application to the assay of inorganic pyrophosphatase. Anal Biochem., 113 (2), 313–317 (1981). DOI: 10.1016/0003-2697(81)90082-8.
- Zinzer E. and Daum G. Isolation and biochemical characterization of organelles from the yeast Saccharomyces cerevisiae. Yeast, 11, 493–536 (1995). DOI: 10.1002/yea.320110602.
- Tkach J. M., Yimit A, Lee A. Y., Riffle M., Costanzo M., Jaschob D., Hendry J. A., Ou J., Moffat J., Boone C., Davis T. N, Nislow C. and Brown G. W. Dissecting DNA damage response pathways by analysing protein localization and abundance changes during DNA replication stress. Nat Cell Biol., 14 (9), 966–976 (2012). DOI: 10.1038/ncb2549.
- Andreeva N. A., Kulakovskaya T. V., Kulakovskaya E. V. and Kulaev I. S. Polyphosphates and exopolyphosphatases in cytosol and mitochondria of Saccharomyces cerevisiae during growth on glucose or ethanol under phosphate surplus. Biochemistry (Moscow), 73 (1), 65–69 (2008). DOI: 10.1134/s0006297908010094.
- Culotta V. C. and Daly M. J. Manganese complexes: diverse metabolic routes to oxidative stress resistance in prokaryotes and yeast. Antioxid Redox Sign, l19 (9), 933–944 (2013). DOI: 10.1089/ars.2012.5093.
- Hothorn M., Neumann H., Lenherr E.D., Wehner M., Rybin V., Hassa P.O., Uttenweiler A., Reinhardt M., Schmidt A., Seiler J., Ladurner A. G., Herrmann C., Scheffzek K. and Mayer A. Catalytic core of a membrane-associated eukaryotic polyphosphate polymerase. Science, 324 (5926), 513–516 (2009). DOI: 10.1126/science.1168120.
- Andreeva N., Ryazanova L., Ledova L., Trilisenko L. and Kulakovskaya T. Stress resistance of Saccharomyces cerevisiae strains overexpressing yeast polyphosphatases. Stresses, 2, 17–25 (2022). DOI: 10.3390/Stresses2010002.
- Umeda C., Nakajima T., Maruhashi T., Tanigawa M., Maeda T. and Mukai Y. Overexpression of polyphosphate polymerases and deletion of polyphosphate phosphatases shorten the replicative lifespan in yeast. FEBS Lett., 597 (18), 2316-2333 (2023). DOI: 10.1002/1873-3468.
- Ahmed Y., Ikeh M. A. C., MacCallum D. M., Day A. M., Waldron K. and Quinn J. Blocking polyphosphate mobilization inhibits pho4 activation and virulence in the pathogen Candida albicans. mBio., 13 (3), e0034222 (2022). DOI: 10.1128/mbio.00342-22.
Лицензия
Copyright (c) 2024 Трилисенко Л. В. , Ледова Л. А. , Рязанова Л. П. , Екатерина Кулаковская, Томашевский А. А. , Кулаковская Т. В. (Автор)

Это произведение доступно по лицензии Creative Commons «Attribution-NonCommercial» («Атрибуция — Некоммерческое использование») 4.0 Всемирная.