Мобилизация кремния в почвах Bacillus subtilis штаммом VKM B-1574
- Организации
-
- 1. Томский государственный университет
- 2. Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН ФИЦ ПНЦБИ РАН
- Опубликован:
- 2025-03-30
- Ключевые слова:
- почвенные микроорганизмы; деструкция минералов; кремний; фосфор; Bacillus, Paenibacillus
Аннотация
Выщелачивание кремния играет важную роль в выветривании горных пород, переработке руд и почвенно-растительных взаимодействиях. Подвижные соединения кремния жизненно необходимы для роста различных растений. При этом разнообразие видов и штаммов бактерий, способных активно выщелачивать кремний из твердых минеральных материалов, крайне ограничено. Идентифицирован штамм Bacillus sp. VKM В-1574, способный растворять минералы в почвах. Анализ последовательностей генов 16S рРНК и gyrB данного штамма выявил наивысшее сходство со штаммом Bacillus subtilis. Показано, что этот штамм способен выщелачивать кремний и другие необходимые химические элементы из фосфоритовой руды, вермикулита, чернозема и городских почв. Анализ биовыщелачивания фосфорита выявил значительное растворение кремния, а сканирующая электронная микроскопия подтвердила бактериальное выщелачивание фосфоритовых пород. Биовыщелачивание вермикулита показало наивысшее содержание растворенных соединений по сравнению с неинокулированными образцами для целого ряда химических элементов, включая редкие. Применение B. subtilis VKM В-1574 к двум образцам почв, на которых выращивались пшеница и огурец, увеличило количество соединений кремния как в почвенных экстрактах, так и в растениях по сравнению с неинокулированными вариантами. В статье обсуждаются возможные механизмы мобилизации кремния, а также роль кремния в росте растений.
Полный текст
Введение
Микроорганизмы играют важную роль в трансформации различных минеральных соединений в почвах [1]. Для роста растения нуждаются в кремнии, калии, фосфоре и ряде других необходимых химических элементах, которые могут быть предоставлены почвенными бактериями, способными растворять минеральные соединения [2-4]. Данная работа посвящена мобилизации минерального кремния (Si), который способствует росту растений и оказывает иные полезные эффекты [5, 6].
Многие почвенные бактерии могут разрушать содержащие кремний минералы либо путем ферментативной деградации кристаллов, либо за счет их разрушения с образованием метаболических продуктов (биогенных кислот и щелочей, хелатирующих агентов и т.д.). Наиболее известным представителем активных "силикатных бацилл" является Paenibacillus mucilaginosus [7], ранее известный как Bacillus mucilaginosus [8]. Он способен синтезировать силиказу, ответственную за разрыв связей Si-O в кристаллической решетке глинистых минералов и кремнийсодержащих соединений [9-11]. Было предпринято множество попыток применения силикатных бацилл для биовыщелачивания ценных металлов из силикатных руд и бокситов [12, 13]. Использование бацилл для обработки силикатных минералов ограничено по экономическим причинам, однако такой подход может быть востребован для извлечения, например, драгоценных металлов из техногенных шлаков.
Поиск новых видов и штаммов, способных разрушать силикатные минералы, продолжается во всем мире. Этот интерес в основном связан с необходимостью поиска силикат-растворяющих бактерий для стимулирования роста растений [14] и получения новых источников силикатов для промышленных целей [15]. Были разработаны специальные методы для скрининга разрушающих силикаты бактерий [16]. В последние десятилетия были зарегистрированы новые штаммы, растворяющие силикатные минералы, например, выделенные с поверхности выветренного полевого шпата [17].
В настоящей работе представлено исследование штамма Bacillus sp. VKM В-1574 и его способности разрушать минеральные соединения и высвобождать кремний и металлы в почвы.
Материалы и методы
2.1. Микроорганизмы
Штамм Bacillus sp. VKM B-1574 был депонирован во Всероссийской коллекции микроорганизмов (ВКМ) более 70 лет назад Ленинградским ветеринарным институтом под названием "Bacillus mucilaginosus" без указания источника его выделения. Соответственно, в наших ранних публикациях мы обозначали данный штамм как "силикатная бактерия" или "B. mucilaginosus" [18]. В отдельных экспериментах по выщелачиванию техногенных стекловидных (силикатных) шлаков для сравнения мы также использовали следующие бациллы из ВКМ: Paenibacillus alvei VKM B-502, P. edaphicus VKM B-2665, P. mucilaginosus VKM B-7519 и P. polymyxa VKM B-514.
2.2. Молекулярные методы идентификации
ДНК выделяли и очищали классическим методом [19]. Клетки суспендировали в 0,5 мл ТЕ-буфера (10 мМ Tris; 1 мМ ЭДТА, рН 8,0) и инкубировали с лизоцимом (5 мкг/мл) в течение 30 мин при 37°C. Затем добавляли 30 мкл 10% SDS и 3 мкл протеиназы К (20 мг/мл), образец тщательно перемешивали и инкубировали 1 ч при 37°C. После добавления 100 мкл 5 M NaCl и 80 мкл раствора CTAB/NaCl (10% CTAB, бромид гексадецилтриметиламмония, Sigma-Aldrich, в 0,7 M NaCl) суспензию инкубировали 10 мин при 65°C. ДНК очищали хлороформом/изоамиловым спиртом, осаждали изопропанолом, промывали 70% этанолом, высушивали и ресуспендировали в 100 мкл ТЕ-буфера.
ПЦР-амплификацию проводили с использованием системы GeneAmp PCR System 2700 ("Applied Biosystems", США). Реакционная смесь (25 мкл) содержала: буфер для Taq-полимеразы (Fermentas, Литва); ДНК, 10 нг; dNTP (Fermentas, Литва), 0,2 мМ; праймеры (Sintol, Россия), по 0,1 мкМ каждого; MgCl₂, 2,5 мМ; и Taq-полимеразу (Fermentas, Литва), 1 ед.
Ген 16S рРНК амплифицировали с использованием следующей пары праймеров: 27f (прямой: 5'-AGAGTTTGATCCTGGCTCAG-3') и 1525r (обратный: 5'-AAGGAGGTGATCCAGCC-3') в следующих условиях: 95ºC в течение 5 мин для денатурации целевой ДНК; 30 циклов: денатурация при 94ºC в течение 30 сек, отжиг праймеров при 55ºC в течение 30 сек и элонгация праймеров при 72ºC в течение 1 мин 20 сек; 72ºC в течение 4 мин для завершения амплификации; охлаждение до 4ºC.
Ген gyrB амплифицировали с использованием пары праймеров: UP-1 (прямой: 5'-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3') и UP-2r (обратный: 5'-AGCAGGGTACGGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3') [20] в следующих условиях: 95ºC в течение 5 мин для денатурации целевой ДНК; 35 циклов: денатурация при 94ºC в течение 1 мин, отжиг праймеров при 60ºC в течение 1 мин и элонгация праймеров при 72ºC в течение 2 мин; 72ºC в течение 7 мин для завершения амплификации; охлаждение до 4ºC.
Амплифицированные продукты анализировали с помощью гель-электрофореза в 1% агарозе (с низким значением электроэндоосмоса, Sigma-Aldrich) в течение 40 мин при 8,3 В/см в ТВЕ-буфере (50 мМ Tris-HCl, 48,5 мМ борная кислота и 1 мМ ЭДТА, рН 8,2). Амплифицированные продукты очищали с использованием набора GeneJET Gel Extraction Kit (Fermentas, Литва) согласно инструкциям производителя.
Секвенирование ДНК проводили с использованием набора реагентов ABI PRISM® BigDye™ Terminator v. 3.1 с последующим анализом продуктов реакции на автоматическом ДНК-секвенаторе ABI PRISM 3730 Applied Biosystems. Секвенирование гена 16S рРНК и гена бета-субъединицы гиразы (gyrB) выполняли с универсальными праймерами 27f, 1525r и Up-1S (прямой: 5'-GAAGTCATCATGACCGTTCTGCA-3') [20].
Полученные последовательности генов 16S рРНК и gyrB сравнивали с депонированными в GenBank с использованием BLAST (NCBI - http://www.ncbi.nlm.nih.gov). Последовательности выравнивали с помощью программы SILVA Incremental Aligner (SINA), версия 1.2.11 (https://www.arb-silva.de/aligner/) [21]. Сходство последовательностей исследуемого и типовых штаммов рассчитывали с использованием TaxonDC 1.2 [22]. Филогенетический анализ выполняли с использованием EzTaxon-e (http://eztaxon-e.ezbiocloud.net/) [23] и программы MEGA версии 7.0. Выравнивание последовательностей ДНК gyrB выполняли с помощью программы Clustal Omega (http://www.ebi.ac.uk/Tools/msa/clustalo/). Филогенетические деревья строили с помощью программы MEGA версии 7.0, с использованием методов neighbor-joining (NJ) [24], maximum-likelihood (ML) [25] и minimum-evolution (ME) [26]. Дерево максимального правдоподобия, построенное на основе последовательностей гена gyrB штамма VKM B-1574 и представителей наиболее близких видов, показано на рисунке 1. Для оценки топологии деревьев использовали бутстреп-анализ на основе 1000 повторных выборок [25].
2.3. Эксперименты по выщелачиванию
Эксперименты по выщелачиванию проводили на следующих объектах: i) фосфоритовая руда, содержащая кремний и фосфор, ii) Версоил - минеральный материал, образованный выветриванием вермикулита, iii) черноземная почва, iv) загрязненная городская почва и техногенные стекловидные шлаки. Фосфоритовая руда была получена с Джерайского месторождения, Узбекистан, ее исходный химический состав (%): P₂O₅ - 13,6; CaO - 44,75; MgO - 1,05; CO₂ - 20,88; Fe₂O₃ - 3,03; SiO₂ - 2,7; Co - 0,11. Стерильные образцы руды либо выдерживали в жидкой среде в стерильных условиях (контроль), либо инокулировали бактериальным штаммом VKM B-1574 в той же среде.
Состав среды (г/л): NH₄Cl - 1,2; MgSO₄ × 7H₂O - 0,1; KCl - 0,23; MnSO₄ - 0,01; MgSO₄ - 0,10; MnSO₄ - 0,01; CoCl₂ - 0,01; Na₂HPO₄ - 0,26; цитрат Na - 1,20; глюкоза - 15; рН - 7,0. Как контрольные, так и экспериментальные образцы в колбах инкубировали при 28ºC в течение одного месяца. Результаты выщелачивания оценивали путем химического анализа жидких сред и электронной микроскопии поверхности породы. Целью эксперимента с выщелачиванием фосфорита было изучение высвобождения фосфора силикатными бациллами.
Образцы Версоил были получены от Горного института, Кольского научного центра РАН. Этот минерал классифицируется как слоистый силикат следующего состава: Mgₓ(Mg,Fe)₃₋ₓ [AlSi₃O₁₀]×(OH)₂×4H₂O. Вермикулит выщелачивали по той же схеме, что и в экспериментах с фосфоритовой породой. Стерильный Версоил помещали в колбы со стерильной питательной средой (контроль) или культурной жидкостью штамма VKM B-1574 (эксперимент) в соотношении 1:3 (твердая фаза : жидкая среда). Как контрольные, так и экспериментальные колбы инкубировали при 28ºC в течение одного месяца. Целью эксперимента с Версоил/вермикулитом было изучение высвобождения всех неорганических соединений, включая редкие элементы.
Образец черноземной почвы отбирали на юге Томской области, Сибирь. Он содержал 8,4% гумуса. Концентрация солей в водной вытяжке чернозема составляла (мг/100 г почвы): NH₄ - 14; NO₃ - 15; P₂O₅ - 70; K₂O - 80; рН 5,8. Образцы городской почвы были взяты в пригороде г. Томска; они представляли собой смесь глины, различного мусора и серой лесной почвы. Содержание гумуса в них составляло 0,5-0,9%; рН 4,2. Концентрация солей в городской почве составляла (мг/100 г): NH₄ - 0; NO₃ - 2,1; P₂O₅ - 5,9; K₂O - 10,3. В экспериментах по выщелачиванию образцы увлажняли дистиллированной водой до 60% от их полной влагоемкости. Затем их инокулировали Bacillus sp. VKM B-1574 (10⁶ КОЕ/мл, 20 мл на 100 г почвы) (эксперимент) или добавляли равный объем питательной среды (контроль). Увлажненные почвы засевали пшеницей Triticum aestivum L. и огурцом Cucumis sativus L. Bacillus sp. VKM B-1574 дополнительно добавляли на 7-й и 15-й дни для пшеницы и на 10-й и 20-й дни для огурцов.
Чтобы выявить возможные механизмы биовыщелачивания техногенных силикатных материалов, мы провели отдельный эксперимент в Институте биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН, направленный на выщелачивание техногенных стекловидных шлаков. Шлаки (зеленое и черное стекло) были получены от ООО "Гвидон Голд", Россия. Данные шлаки образовывались в процессе пирометаллургической переработки вторичного сырья, содержащего драгоценные металлы: серебро, золото, палладий, платину (60-200 г/т), подвергались дроблению и последующему грохочению по классу крупности <1 мм. Драгоценные металлы находились в шлаках в виде мелких сплавленных капель тонкой сферической фракции. Эти металлы не имели растворенных форм, и об их высвобождении из шлаков можно было судить по общему разрушению материала или по высвобождению железа и никеля как косвенных показателей. Химический состав шлаков согласно ООО "Гвидон Голд" составлял (%): Fe- 51,00; S -- 29,77; Si -- 3,62; Ca -- 1,75; Al -- 1,21; Ni -- 1,15; Mg -- 0,86; Cu -- 0,11; Co -- 0,04. Выщелачивание происходило за счет экзополисахаридов, продуцируемых Bacillus sp. VKM B-1574 и другими бациллами, а именно: P. alvei VKM B-502, P. edaphicus VKM B-2665, P. mucilaginosus VKM B-7519 и P. polymyxa VKM B-514. Для получения экзополисахаридов выращенную бактериальную биомассу собирали, подвергали лизису, затем центрифугировали в течение 10 мин при 13,4 тыс. об/мин для осаждения всех возможных механических примесей. Затем брали супернатант и добавляли 1 мл полученной бактериальной слизи к 9 мл дистиллированной воды. Конечный раствор смешивали с измельченными шлаками в соотношении 5:1 (жидкая фаза : твердая фаза). Экспозицию проводили в течение 3 дней при 28°C.
2.4. Химические анализы
Концентрацию подвижных соединений кремния - моно-, поликремниевых кислот и органического кремния определяли фотометрически при длине волны 660 нм [27, 28]. Каждый образец помещали в дистиллированную воду (5 г/150 мл) и перемешивали блендером. Процедуру повторяли через 24 ч, затем образцы центрифугировали и анализировали супернатанты на наличие растворенных соединений. Концентрацию монокремниевых кислот оценивали фотометрическим методом с гептамолибдатом аммония: классический метод Маллена-Райли [29] использовали для устранения мешающего влияния фосфатов. Две аликвоты полученного раствора по 20 мл каждая отбирали для следующих анализов.
Первую порцию обрабатывали ультразвуком в течение 3 мин для ускорения деполимеризации поликремниевых кислот. Затем добавляли 0,1 г NaOH для полной деполимеризации поликремниевых кислот и разрушения водорастворимых органосиликоновых соединений. Образец выдерживали в течение 2 недель, затем содержание монокремниевых соединений оценивали методом Маллена-Райли [29]. Полученное значение соответствовало сумме моно- и поликремниевых кислот и кремния подвижных органосиликоновых соединений.
Вторую порцию дополняли 0,5 г активированного угля для адсорбции органосиликоновых соединений. Затем образец фильтровали, обрабатывали ультразвуком и добавляли 0,1 г NaOH (как указано выше). Полученный образец также сохраняли в течение 2 недель, затем концентрацию кремниевых кислот оценивали методом Маллена-Райли [29]. Полученное значение соответствовало сумме моно- и поликремниевых кислот без кремния любых подвижных органосиликоновых соединений.
Другие растворенные неорганические соединения анализировали методом масс-спектрометрии с индуктивно связанной плазмой (ICP-MS, Perkin-Elmer ELAN-DRC-e) в Центре "Вода" Томского политехнического университета. Все анализы проводились в соответствии с программным пакетом ELAN, поставляемым с оборудованием.
В экспериментах со стекловидными шлаками катионы никеля и железа анализировали с использованием:
(i) Ионного хроматографа Metrohm 838 для детектирования катионов 844 UV/VIS Compact IC с хроматографической колонкой 6.1010.300 Metrosep (3×150 мм)
(ii) Атомно-абсорбционного спектрофотометра SHIMADZU АА-6800 (Shimadzu, Япония), управляемого программным обеспечением WizAArd.
2.5. Сканирующая электронная микроскопия фосфоритовой породы
Порошок фосфорита помещали на предметный столик, покрытый тонким слоем клея, затем напыляли серебром в вакууме. Полученный образец исследовали под электронным микроскопом JEM-100 CXII (JEOL, Япония) с ASID-4D при ускоряющем напряжении 20 кВ.
2.6. Биохимические анализы
Биогенные органические продукты анализировали в жидкой культуральной среде после 48 ч роста Bacillus sp., VKM B-1574 при 29°C. Среда содержала (г/л): NH₄Cl - 1,2; MgSO₄ × 7H₂O - 0,1; KCl - 0,23; MnSO₄ - 0,01; MgSO₄ - 0,10; MnSO₄ - 0,01; CoCl₂ - 0,01; Na₂HPO₄ - 0,26; цитрат Na - 1,20; глюкоза - 15; рН - 7,0.
Фитохромы анализировали с использованием ELISA-наборов OLCHEMIM (Чехия). Аскорбиновую кислоту определяли по реакции с 2,6-дихлорфенолиндофенолом [30]; сахара - с феррицианидом калия; гидролиз полисахаридов проводили в 2% HCl в течение 2 ч [31]; концентрацию флавоноидов определяли в спиртовых экстрактах с AlCl₃ [32]. Оптическую плотность измеряли с помощью многофункционального анализатора Victor (Pribori Oy, Финляндия).
2.7. Статистика
Все эксперименты и анализы проводили в 3 повторностях. Статистический анализ выполняли с использованием стандартных методов, предоставляемых программой Excel. Для определения достоверности полученных данных использовали дисперсионный анализ (ANOVA). Все представленные в статье данные достоверны (p > 99%).
Результаты
3.1. Идентификация Bacillus sp. VKM B-1574
Последовательность гена 16S рРНК для Bacillus sp. VKM B-1574 содержала 1468 п.н. Анализ EzBioCloud показал, что штамм VKM B-1574 имел наивысшее сходство последовательностей (100%) с последовательностью гена 16S рРНК типового штамма вида, а именно B. subtilis subsp. subtilis NCIB 3610T. Сходство последовательностей гена 16S рРНК с другими типовыми штаммами видового комплекса B. subtilis было ниже 99,79%.
В целом представители группы B. subtilis имеют высокое фенотипическое сходство и идентичные или почти идентичные последовательности гена 16S рРНК; однако они различаются по составу жирных кислот и имеют низкие значения ДНК-ДНК гибридизации между различными представителями видового комплекса [33]. Для B. subtilis было показано высокое сходство последовательностей бета-субъединицы гиразы (gyrB) и ДНК-ДНК связывания [33, 34]. Таким образом, филогенетический анализ на основе последовательности гена gyrB можно использовать для различения представителей этой группы на межвидовом и внутривидовом уровнях [35]. Мы проанализировали ген gyrB штамма VKM B-1574. Полученная последовательность gyrB имела длину 771 нт. Попарные сравнения последовательностей гена gyrB показали, что ближайшим родственником (99,9% сходства последовательностей) штамма VKM B-1574 является B. subtilis BCRC 10255T = NCIB 3610T. Филогенетические деревья, рассчитанные методами ML, MJ и ME, четко продемонстрировали сходную топологию и указали на то, что штамм VKM B-1574 помещается в монофилетический кластер группы B. subtilis и образует когерентный кластер с типовым штаммом B. subtilis BCRC 10255T (дерево показано на рис. 1).
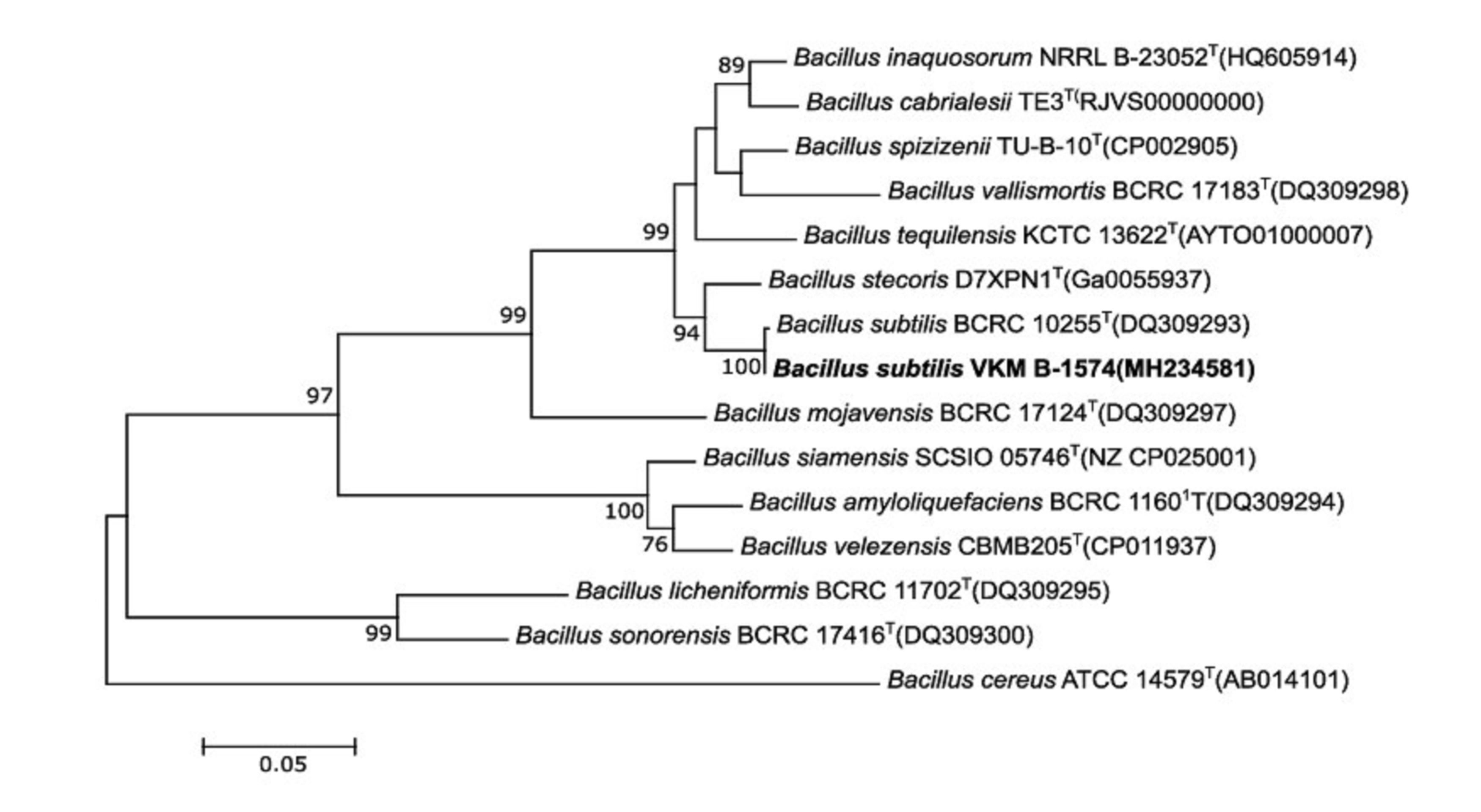
Рисунок 1. Филогенетическое дерево максимального правдоподобия, основанное на частичных последовательностях гена gyrB, показывающее положение штамма VKM B-1574 среди ближайших видов рода Bacillus. Числа в узлах представляют бутстреп-значения, показанные в процентах от 1000 повторностей; показаны только значения >50%. Номера GenBank приведены в скобках. Масштабная линейка соответствует 0,05 замен на нуклеотид.
3.2. Выщелачивание Si и P из фосфоритовой руды
Результаты выщелачивания фосфорита представлены в таблице 1 и на рис.2. Процесс биовыщелачивания был подтвержден сканирующей электронной микроскопией, которая выявила наличие множества клеток на поверхности породы, а также определенные изменения в структуре породы.
Таблица 1. Выщелачивание Si и P из фосфоритовой руды B. subtilis VKM B-1574.4.
|
Инкубация, дни |
Число бактерий в инокулиро-ванных экспериментах, 10⁸ кл/мл |
Растворенный Si, мг SiO2/л |
Растворенный P, мг РО42-/л |
||
|
Эксперименты с B.subtilis VKM B-1574 |
Стерильные эксперименты (контроль) |
Эксперименты с B.subtilis VKM B-1574 |
Стерильные эксперименты (контроль) |
||
|
5 |
0.0026 |
9.25 |
6.25 |
0.55 |
0.45 |
|
10 |
11.5 |
16.75 |
6.88 |
1.25 |
0.63 |
|
30 |
22.0 |
17.25 |
7.10 |
1.63 |
0.72 |
3.3. Выщелачивание вермикулита
В экспериментах с вермикулитом изучали способность B. subtilis VKM B-1574 выщелачивать различные химические элементы, включая редкоземельные. Химические анализы растворенных солей после 30 дней экспозиции выявили повышенную активность бактерий в процессе выщелачивания, что подтверждалось наличием высоких концентраций растворенных химических соединений в инокулированных образцах по сравнению со стерильными (контрольными): концентрация растворенного железа увеличилась в 22,6 раза, магния - в 4,6 раза, кремния - в 3,7 раза и т.д. (Таблица 2). Примечательно, что концентрация растворенных P, Se, B и некоторых редкоземельных элементов снизилась, вероятно, из-за их селективного поглощения бактериями.
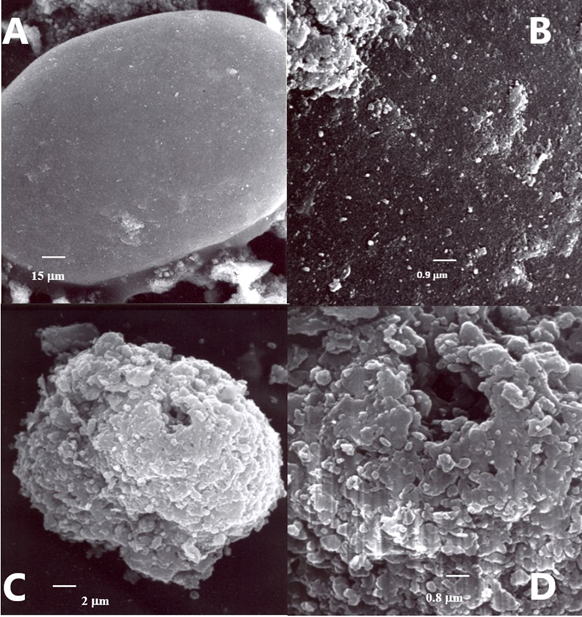
Рисунок 2. Сканирующая электронная микроскопия поверхности фосфоритовой породы после 30 дней экспозиции в жидкой среде. А, B - контроль, без B. subtilis VKM B-1574; C, D - эксперимент с B. subtilis VKM B-1574. Микрофотографии демонстрируют колонизацию минерала бактериальными клетками при инокуляции.
Таблица 2. Выщелачивание вермикулита в жидкой среде, мг/л.
|
Хим. элемент |
Стерильные эксперименты(контроль) |
Выщелачив. с B.subtilis VKM B-1574 |
Хим. элемент |
Стерильные эксперименты(контроль) |
Выщелачив. с B. subtilis VKM B-1574 |
|
Na |
484.47 |
519.03 |
Ni |
0.037 |
0.17 |
|
K |
128.56 |
133.53 |
Rb |
0.032 |
0.012 |
|
Ca |
122.72 |
238.31 |
Li |
0.020 |
0.036 |
|
Mg |
84.67 |
387.71 |
Mo |
0.020 |
0.031 |
|
Si |
26.65 |
98.02 |
Co |
0.015 |
0.056 |
|
P |
2.32 |
0.72 |
Ge |
0.010 |
0.015 |
|
Fe |
1.61 |
36.43 |
Sc |
<0.01 |
<0.01 |
|
Sr |
0.79 |
1.21 |
Ga |
0.009 |
0.0090 |
|
B |
0.42 |
0.30 |
Se |
0.0088 |
0.0026 |
|
Cu |
0.12 |
0.17 |
Zr |
0.0032 |
0.019 |
|
Mn |
0.085 |
3.41 |
Nb |
0.0029 |
0.024 |
|
Al |
0.078 |
25.27 |
Y |
0.00012 |
0.0028 |
|
Ti |
0.076 |
1.48 |
Ag |
0.000061 |
0.00043 |
|
Zn |
0.061 |
0.39 |
V |
<0.000005 |
<0.000005 |
|
Cr |
0.054 |
0.25 |
Be |
<0.000004 |
0.00071 |
3.4. Образование подвижных Si-соединений в почвах
Для изучения возможной положительной роли B. subtilis VKM B-1574 в улучшении почв мы проанализировали конечные концентрации мобилизованного кремния в виде моно- и поликремниевых кислот и органосиликоновых соединений как в почвах, так и в растениях. Очевидно, что органосиликоновые соединения присутствовали в растениях, но не в почве. Концентрация монокремниевых кислот была выше как в черноземе, так и в городской почве. В целом концентрация мобилизованных Si-соединений была выше в инокулированных образцах по сравнению с контрольными (неинокулированными) (Таблицы 3, 4).
Таблица 3. Соединения кремния в черноземе и растениях огурца, мг SiO2/100 г, через 60 д.
|
|
Чернозем, контроль |
Чернозем, инокуляция |
Огурец, растение, контроль |
Огурец, растение, инокуляция |
|
Монокремниевые кислоты |
23.0 |
29.0 |
71.8 |
84.8 |
|
Поликремниевые кислоты |
13.7 |
9.2 |
30.4 |
38.6 |
|
Органосиликоновые соединения |
<1.0 |
<1.0 |
6.2 |
17.0 |
|
Всего |
36.7 |
38.2 |
108.4 |
140.4 |
Таблица 4. Соединения кремния в городской почве и растениях пшеницы, мг SiO2/100 г, через 15 д.
|
|
Почва, контроль |
Почва, инокуляция |
Пшеница, растение, контроль |
Пшеница, растение, инокуляция |
|
Монокремниевые кислоты |
5.7 |
12.1 |
32.0 |
30.6 |
|
Поликремниевые кислоты |
2.6 |
7.0 |
7.6 |
29.1 |
|
Органосиликоновые соединения |
<1.0 |
<1.0 |
33.3 |
39.5 |
|
Всего |
8.3 |
19.1 |
72.9 |
99.2 |
3.5. Активные выщелачивающие соединения
Способность многих видов бацилл извлекать биогенные элементы из минералов и почв хорошо известна. При попытках понять механизм выщелачивания возникла гипотеза, что бациллы в основном высвобождают кремний и фосфор с помощью биогенных органических кислот [36-38]. При этом, отдельные исследования показали, что B. mucilaginosus разрушает минеральные кремниевые соединения при участии полисахаридов. Было сделано предположение, что полисахариды просто адсорбируют эти биогенные органические кислоты [10]. Позже мы показали, что сами полисахариды могут разрушать структуры поликремниевых минералов [11]. Этот вывод согласуется с ранее предложенным химическим механизмом [39]. В соответствии с этими данными мы провели химический анализ культуральной среды после 48 часов роста B. subtilis VKM B-1574, который показал присутствие значительного количества как полисахаридов, так и биогенных органических кислот, включая аскорбиновую и кетокислоты (Таблица 5). Таким образом, B. subtilis VKM B-1574 продуцирует слизь и кислоты и может воздействовать на минералы двумя способами: либо путем разрушения кристаллических решеток с помощью ферментов, либо путем их разложения микробной слизью. Кроме того, мы показали, что в процессе культивирования B. subtilis VKM B-1574 накапливал различные биологически активные вещества в культуральной среде (Таблица 5).
Можно предположить, что активность бактериального выщелачивания и механизмы его реализации зависят не только от выбранного штамма/вида, но и от характеристик перерабатываемого минерального сырья. Возможность использования B. subtilis VKM B-1574 для промышленной экстракции металлов из стекловидных шлаков как вторичного минерального сырья была отдельным направлением исследований. Основной целью этих исследований было извлечение драгоценных металлов, однако, поскольку они не растворялись, расчетными показателями деградации минерального сырья служили показатели извлечения Ni и Fe [11, 40].
Таблица 5. Содержание некоторых биогенных соединений в культуральной среде B. subtilis VKM B-1574 после 48 ч роста.
|
Биогенные соединения |
Концентрация, мг/л |
Биогенные соединения |
Концентрация, мг/л |
|
Аскорбиновая кислота |
1875 |
Смешанные кетокислоты |
17.25 |
|
Общие сахара |
316 |
Пировиноградная кислота |
0.98 |
|
Полисахариды |
266 |
Кетоглутаровая кислота |
0.32 |
|
Смешанные флавоноиды |
163 |
Дигидрозеатин рибозид |
0.037 |
|
Восстанавливающие сахара |
50 |
Изопентениладенозин |
0.005 |
|
Индол-3-уксусная кислота |
25.9 |
Трансзеатин рибозид |
0.0004 |
Таблица 6. Сравнение выщелачивания Fe и Ni из техногенных шлаков с использованием экзополисахаридов различных микроорганизмов (по [11]).
|
Вариант инокуляции |
Концентрация в культуральной среде, мг/л |
|
|
Ni |
Fe |
|
|
Контроль |
0.08 |
6.82 |
|
Bacillus sp. VKM B-1574 |
<0.05 |
4.00 |
|
Paenibacillus alvei VKM B-502 |
<0.05 |
8.00 |
|
P. polymyxa VKM B-514 |
< 0.05 |
8.00 |
|
P. edaphicus VKM B-2665 |
0.78 |
134.82 |
|
P. mucilaginosus VKM B-7519 |
0.86 |
143.45 |
Мы сравнили B. subtilis VKM B-1574 с другими бациллами по способности к деградации шлаков. Результаты представлены в Таблице 6. Видно, что экзополисахариды только двух использованных культур обладали необходимой промышленной выщелачивающей активностью, а именно P. edaphicus VKM B-2665 и P. mucilaginosus VKM B-7519. Экзополисахариды других бацилл, включая B. subtilis VKM B-1574, были недостаточно эффективны для перевода этих металлов в раствор. Таким образом, полученные данные могут свидетельствовать о том, что деградация стекловидных кремниевых связей B. subtilis VKM B-1574 обеспечивается бактериальными ферментами, а не экзополисахаридами. Сопоставление этой информации с опубликованными данными об активных метаболитах B. subtilis VKM B-1574 (Таблица 5) и мобилизации кремния из других источников (Таблицы 2-4) открывает широкое поле для будущих исследований.
В целом, результаты сканирующей электронной микроскопии (Рис. 2) и анализ содержания некоторых биогенных соединений (Таблица 5) показали, что штамм B. subtilis VKM B-1574 может использоваться совместно с минералами, формируя комплексные удобрения.
Обсуждение
Стимулирующее действие кремния (Si) на растения широко известно и применяется на практике: кремниевые удобрения используются в сельском хозяйстве для повышения урожайности культурных растений [41]. Применение (Si+P)-удобрений усиливает активность почвенных бактерий, направленную на мобилизацию необходимых химических элементов из твердых минералов. В частности, это проверенный способ обеспечения растений доступными соединениями фосфора [42].
Наши эксперименты с вермикулитом показали, что бактерии воздействуют на алюмосиликаты; выщелачивание приводит к растворению/мобилизации многочисленных химических элементов, включая кремний и алюминий. Двухвалентные катионы извлекаются в значительно большей степени по сравнению с пассивным химическим выщелачиванием. На сегодняшний день накоплен значительный объем информации о способности бацилл разрушать различные минералы [9-11, 43]. Согласно опубликованным данным и нашим результатам, к биогенным растворимым соединениям относятся органические кислоты (галловая, щавелевая, лимонная, салициловая, пирокатехиновая, бензойная и др.), экзополисахариды и некоторые ферменты (гидролазы, оксидоредуктазы и др.). Как показано в Таблице 5, биохимические анализы культуральной среды после 48 часов роста B. subtilis VKM B-1574 выявили присутствие значительных количеств не только полисахаридов, сахаров и кислот, но и важных биологически активных соединений. Таким образом, бактерии могут: (i) разрушать минералы кислотами, ферментами или полисахаридами и (ii) стимулировать рост растений за счет других механизмов. B. subtilis VKM B-1574, по-видимому, обладает обеими способностями, что важно для практического использования этого микроорганизма в сельском хозяйстве.
Показано, что в процессе культивирования B. subtilis может накапливать в среде различные биологически активные вещества, помимо перечисленных в Таблице 5. Эти бактерии способны продуцировать около 200 антибиотиков, аминокислот, витаминов, фитогормонов, а также карбоновые органические кислоты (молочную, уксусную, масляную), ди- и трикарбоновые кислоты – щавелевую, яблочную, лимонную [44]. Мы обнаружили три типа цитокининов: дигидрозеатин рибозид, изопентениладенозин и трансзеатин рибозид. После инокуляции растений огурца этим бактериальным штаммом концентрация цитокининов и индол-3-уксусной кислоты увеличивалась, тем самым стимулируя рост растений. Мы также установили, что обработка пшеницы B. subtilis VKM B-1574 способствовала значительному укреплению стебля и листьев злака за счет накопления кремния в тканях растения [18]. Способность штамма VKM B-1574 синтезировать флавоноиды также представлена в Таблице 5. Эти соединения по своей природе являются фенольными. Для другого штамма B. subtilis [44] была показана продукция фенилуксусной (29,03%) и 4-гидроксифенилуксусной кислот (10,49%) в значительных количествах. Данные соединения способны индуцировать корнеобразование у растений.
В представленной работе мы продемонстрировали способность B. subtilis VKM B-1574 извлекать кремний и включать его в биогенные кремнийсодержащие соединения. Также была показана биогенная экстракция других неорганических солей из твердых минералов. В целом, эти результаты позволяют предположить, что применение B. subtilis VKM B-1574 к различным типам почв будет оказывать положительное влияние на процесс мобилизации основных химических элементов в форму, доступную для растений.
Органосиликоновые соединения не были обнаружены в исследуемых почвах (Таблица 3), но их содержание увеличивалось в растениях после применения бактерий. Результаты экспериментов показали, что содержание биолитов в растениях пшеницы и огурца было выше, чем в контрольном варианте. У растений, выращенных на черноземе, наблюдалось увеличение содержания органосиликоновых соединений более чем в 2 раза; в городской почве уровень этих соединений также повышался, но не столь значительно. По-видимому, поликремниевые кислоты служат основой для образования биолитов растений.
Водный обмен и полимеризация Si являются двумя основными факторами, обеспечивающими высокую концентрацию кремниевой кислоты в побегах растений [45]. Интенсивность поглощения Si варьирует в зависимости от вида растения [46]. У злаков и огурца транспорт Si может быть опосредован различными специфическими системами и отличаться по энергетическим затратам. У пшеницы дополнительный Si в форме мономерной кремниевой кислоты присутствует в ксилеме [46]. Огурец не поглощает Si так быстро, как растения пшеницы, но при высоких концентрациях Si в почве его поглощение может увеличиваться. При этом содержание Si в листьях растения может достигать уровня, характерного для злаков [47].
Выводы
Ранее мы использовали штамм Bacillus sp. VKM B-1574 для выщелачивания и мобилизации основных питательных веществ из минералов с целью их использования в системе почва-растение [48]. В представленной работе мы идентифицировали Bacillus sp. VKM B-1574 как B. subtilis с высоким сходством с типовым штаммом вида по последовательностям генов 16S рРНК и gyrB. Мы также показали его высокую эффективность в выщелачивании фосфатной руды и вермикулита (Версоил), которые, в свою очередь, могут использоваться в качестве почвенных удобрений. Кроме того, мы инокулировали B. subtilis VKM B-1574 в два типа почв, засеянных пшеницей и огурцом, и продемонстрировали увеличение количества мобилизованных соединений Si как в почвенных экстрактах, так и в тканях растений по сравнению с неинокулированными (контрольными) вариантами.
Рассмотрены возможные механизмы мобилизации Si, и роль кремния в растениях. Различные бактериальные метаболиты – кислоты, сахара, экзополисахариды, ферменты – могут быть использованы для мобилизации кремния в зависимости от минерала. Мы не обнаружили активного разрушения стекла биогенными экзополисахаридами. Тем не менее, на основании исследования мы можем констатировать, что штамм B. subtilis BKM B-1574 активно выщелачивает кремнийсодержащие минералы и может использоваться вместе с таковыми для создания комплексных удобрений. Тот факт, что изученный активный штамм принадлежит к B. subtilis, расширяет пространство для поиска новых промышленных штаммов данного вида.
Финансирование
Работа поддержана Министерством науки и высшего образования Российской Федерации.
Список литературы
- Torsvik V. Microbial diversity and function in soil: from genes to ecosystems. Curr. Opin. Microbiol. 1, 240-245 (2002). DOI: 10.1016/s1369-5274(02)00324-7.
- Basak B.B., Sarkar B., Biswas D.R., Sarkar S., Sanderson P. and Naidu R. Bio-intervention of naturally occurring silicate minerals for alternative source of potassium: challenges and opportunities. Adv. Agron., 141, 115-145 (2017). DOI: 10.1016/bs.agron.2016.10.016.
- Greger M., Landberg T. and Vaculík M. Silicon influences soil availability and accumulation of mineral nutrients in various plant species. Plants., 7 (2), 41 (2018). DOI: 10.3390/plants7020041.
- Pastore G., Kernchen S. and Spohn M. Microbial solubilization of silicon and phosphorus from bedrock in relation to abundance of phosphorus-solubilizing bacteria in temperate forest soils. Soil Biol. Biochem., 151, 108050 (2020). DOI: 10.1016/j.soilbio.2020.108050.
- Barão L., Teixeira, R., Vandevenne F. and Struyf E. Silicon mobilization in soils: the broader impact of land use. Silicon., 12, 1529–1538 (2020). DOI: 10.1007/s12633-019-00245-y.
- Katz O., Puppe D., Kaczorek D., Prakash N.B. and Schaller, J. Silicon in the soil–plant continuum: intricate feedback mechanisms within ecosystems. Plants., 10, 652 (2021). DOI: 10.3390/plants10040652.
- Hu X.F., Li S.X., Wu J.G., Wang J.F., Fang Q.L. and Chen J.S. Transfer of Bacillus mucilaginosus and Bacillus edaphicus to the genus Paenibacillus as Paenibacillus mucilaginosus. Int. J. Syst. Evol. Microbiol., 60, 8-14 (2010). DOI: 10.1099/ijs.0.008532-0.
- Avakyan Z.A., Pivovarova T.A., Karavaiko G.I. Bacillus mucilaginosus sp. nov. In Validation of the publication of new names and new combinations previously effectively published outside the IJSB, List no. 66. Int. J. Syst. Bacteriol., 48, 631–632 (1988).
- Karavaiko G.I. Microbial destruction of silicate minerals. Trudy Instituta mikrobiologii imeni S.N. Vinogradskogo RAN [Proceedings of the Vinogradskii Institute of Microbiology, Russ. Ac. Sci.], 172-196 (2004).
- Liu W., Xu X., Wu X., Yang Q., Luo Y. and Christie P. Decomposition of silicate minerals by Bacillus mucilaginosus in liquid culture. Environ. Geochem. Health., 28 (1-2), 133-40 (2006). DOI: 10.1007/s10653-005-9022-0.
- Abashina T. N., Delegan Y. A., Yatskiv A. A., Vainshtein M. B., and Kumar S. Bioleaching metals from glassy slags with silicate bacteria. In Proc. the 5th Pushchino school-conference “Biochemistry, Physiology and Biospheric Role of Microorganisms.” (Pushchino, Publishing house “Water: Chemistry and Ecology”, 2018), pp. 42-44.
- Sukla L.B., Panchanadikar V.V., Kar R.N. Microbial leaching of lateritic nickel ore. World J Microbiol. Biotechnol., 9, 255–257 (1993). DOI: 10.1007/BF00327850.
- Zhan S. Liu J., Chen Y. and Sun D. Single and coorperative bauxite bioleaching by silicate bacteria. IERI Procedia., 5, 172-177 (2013). DOI: 10.1016/j.ieri.2013.11.088].
- Cruz J.A., Tubana B.S., Fultz L.M., Dalen M.S. and Ham, J.H. Identification and profiling of silicate-solubilizing bacteria for plant growth-promoting traits and rhizosphere competence. Rhizosphere., 23, 100566 (2022). DOI: 10.1016/j.rhisph.2022.100566.
- Toender J. E., and Borchert M. Use of enzymes having silicase activity. Patent USA № US8822188B2, publ. 02.09.2014.
- Kaur P., Sharma A. Bhardwaj N.K., Singh A., Dalal S. and Sharma J. A novel, simple, and quick plate assay to screen silicolytic bacteria and silicase production using different substrates. Technol. Rep., 17, 100971 (2022). DOI: 10.1016/j.biteb.2022.100971.
- Sheng X.F., Zhao F., He L.Y., Qiu G. and Chen L. Isolation and characterization of silicate mineral-solubilizing Bacillus globisporus Q12 from the surfaces of weathered feldspar. Can. J. Microbiol., 54 (12), 1064-1068 (2008). DOI: 10.1139/W08-089.
- Sokolova M., Belogolova G., Akimova G. and Vayshlya O. The role of silicate rhizobacteria in the biosorption of silicon in the soil-plant system during polyelemental soil contamination. Agrokhimiya., 1, 71-77 (2019).
- Ausubel F.M., Brent M., Kingston R.E., Moore D.D., Seidman J.G., Smith J.A. and Struhl, K. Current Protocols in Molecular Biology. New York: Wiley., 650 (1994).
- Yamamoto S. and Harayama S. PCR amplification and direct sequencing of gyrB genes with universal primers and their application to the detection and taxonomic analysis of Pseudomonas putida strains. Appl. Environ. Microbiol., 61, 1104-1109 (1995). DOI: 10.1128/aem.61.3.1104-1109.1995.
- Pruesse E., Peplies J. and Glöckner F.O. SINA: accurate high-throughput multiple sequence alignment of ribosomal RNA genes. Bioinformatics., 18, 1823-1829 (2012). DOI: 10.1093/bioinformatics/bts252.
- Tarlachkov S.V. and Starodumova I.P. Taxon DC Calculating the similarity value of the 16S rRNA gene sequences of prokaryotes or ITS regions of fungi. J. Bioinf. Genomics., 16, 1-4 (2017). DOI: 10.18454/jbg.2017.3.5.1
- Yoon S., Ha S., Kwon S., Lim J. and Kim Y. Introducing EzBioCloud: A taxonomically united database of 16S rRNA and whole genome assemblies. Int. J. Syst. Evol. Microbiol., 67( 5), 1613-1617 (2017). DOI: 10.1099/ijsem.0.001755.
- Saitou N. and Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Mol. Biol. Evol., 4, 406-425 (1987). DOI: 10.1093/oxfordjournals.molbev.a040454.
- Felsenstein J. Confidence limits on phylogenies: An approach using the bootstrap. Evolution., 39, 783-791 (1985). DOI: 10.1111/j.1558-5646.1985.tb00420.x.
- Takahashi K. and Nei M. Efficiencies of fast algorithms of phylogenetic inference under the criteria of maximum parsimony, minimum evolution, and maximum likelihood when a large number of sequences are used. Mol. Biol. Evol., 17, 1251-1258 (2000). DOI: 10.1093/oxfordjournals.molbev.a026408.
- Matychenkov, V.V. and Shnaider G.S. Mobile silicon compounds in some South Florida soils. Pochvovedenie., 12, 1448-1453 (1996).
- Matichencov V. V., and Bocharnikova E. A. The relationship between silicon and soil physical and chemical properties. In Silicon in Agriculture, Studies in Plant Science, vol. 8, Ed. by Datnoff L. E., Snyder G. H., and Korndörfer G. H. (Amsterdam, The Netherlands, Elsevier, 2001), pp. 209–219.
- Mullin J., and Riley J.P. The colorimetric determination of silicate with special reference to sea and natural waters. Anal. Chim. Acta., 12, 162-176 (1955). DOI: 10.1016/S0003-2670(00)87825-3.
- Hughes D.E. Titrimetric determination of ascorbic acid with 2,6-dichlorophenol indophenol in commercial liquid diets. J. Pharm. Sci., 72 (2), 126-129 (1983). DOI: 10.1002/jps.2600720208.
- Liu J. and Jiang G. Spectrophotometric flow injection determination of total reducing sugars in tobacco based on oxidation by ferricyanide and formation of Prussian blue. Analytical Letters., 34 (11), 1923-1934 (2001). DOI: 10.1081/AL-100106122.
- Mahboubi M., Kazempour N. and Boland Nazar A.R. Total phenolic, total flavonoids, antioxidant and antimicrobial activities of Scrophularia striata Boiss extracts. Jundishapur J. Nat. Pharm. Prod., 8 (1), 15-19 (2013). PMCID: PMC3941883.
- Rooney A.P., Price N.P., Ehrhardt C., Swezey J.L. and Bannan J.D. Phylogeny and molecular taxonomy of the Bacillus subtilis species complex and description of Bacillus subtilis sp. in aquosorum subsp. nov. Int. J. Syst. Evol. Microbiol., 45, 2420-2436 (2009). DOI: 10.1099/ijs.0.009126-0.
- Kasai H., Watanabe K., Gasteiger E., Bairoch A., Isono K., Yamamoto S., and Harayama S. Construction of the gyrB database for the identification and classification of bacteria. In Genome Informatics (Tokyo, Universal Academic Press, 1998), vol. 21.
- Wang L.T., Lee F.L., Tai C.J. and Kasai H. Comparison of gyrB gene sequences, 16S rRNA gene sequences and DNA-DNA hybridization in the Bacillus subtilis group. Int. J. Syst. Evol. Microbiol., 8, 1848-1850 (2007). DOI: 10.1099/ijs.0.64685-0.
- Ameen F., AlYahya S.A., AlNadhari S., Alasmari H., Alhoshani F. and Wainwright M. Phosphate solubilizing bacteria and fungi in desert soils: species, limitations and mechanisms. Arch. Agron. Soil Sci., 65 (10), 1446-1459 (2019). DOI: 10.1080/03650340.2019.
- Bist V., Niranjan A., Ranjan M., Lehri A., Seem K. and Srivastava S. Silicon-solubilizing media and its implication for characterization of bacteria to mitigate biotic stress. Front. Plant Sci., 11, 28 (2020). DOI: 10.3389/fpls.2020.00028.
- Raturi G., Sharma Y., Rana V., Thakral V., Myaka B., Salvi P., Singh M., Dhar H. and Deshmukh Exploration of silicate solubilizing bacteria for sustainable agriculture and silicon biogeochemical cycle. Plant Physiol. Biochem., 166, 827-838 (2021). DOI: 10.1016/j.plaphy.2021.06.039.
- Lambert J.B., Gurusamy-Thangavelu S.A. and Ma K. The silicate-mediated formose reaction: bottom-up synthesis of sugar silicates. Science., 327 (5968), 984-986 (2010). DOI: 10.1126/science.1182669.
- Yachkula A. A., Yatskiv A. A., Bykov A. G., Abashina T. N., and Vainshtein M. B. Application of exopolysaccharides of bacteria of the genus Paenibacillus for bioleaching of silicate ores. In XXXIII Winter International Youth Scientific School “Perspective directions of physical and chemical biology and biotechnology”, Moscow, February 8-11, 2021. Abstract 189. (Moscow, IBCh RAS, 2021), 256 p.
- Artyszak A. Effect of silicon fertilization on crop yield quantity and quality. Plants., 87, 1-17 (2018). DOI: 10.3390/plants7030054.
- Ibrahim M., Iqbal M., Tang Y.T., Khan S., Guan D.X. and Li G. Phosphorus mobilization in plant–soil environments and inspired strategies for managing phosphorus: A Review. Agronomy., 12, 2539. DOI: 10.3390/agronomy12102539.
- Lv Y., Li J., Ye H., Du D., Li J., Sun P., Ma M. and Wen J. Bioleaching behaviors of silicon and metals in electrolytic manganese residue using silicate bacteria. J. Clean. Product., 228, 901-909 (2019). DOI: 10.1016/j.jclepro.2019.04.289.
- Tserkovniak L.S. and Kurdish I.K. Phosphate-mobilizing bacteria Bacillus subtilis as phenolic producers. Appl. Biochem. Microbiol., 45, 279–284 (2009). DOI: 10.1134/S0003683809030077.
- Shwethakumari U. and Prakash N.B. Effect of foliar application of silicic acid on soy bean yield and seed quality under field conditions. J. Ind. Soc. Soil Sci., 66 (4), 406-414 (2018). DOI:10.5958/0974-0228.2018.00051.8.
- Liang Y., Sun W., Zhu Y.G. and Christie P. Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants: a review. Environ. Pollution., 54, 422-428 (2007). DOI: 10.1016/j.envpol.2006.06.008.
- Miyake Y. and Takahashi E. Effect of silicon on the growth of solution-cultured cucumber plant. Soil Sci. Plant Nutr., 56, 71-83 (1993). DOI: 10.1080/00380768.1983.10432407.
- Belogolova G.А., Sokolova M.G., Gordeeva О.N. and Vaishlya О.B. Speciation of arsenic and its accumulation by plants from rhizosphere soils under the influence of Azotobacter and Bacillus bacteria. J. Geochem. Explor., 149, 52-58 (2015). DOI: 10.1016/j.gexplo.2014.11.017.
Лицензия
Copyright (c) 2025 Ольга Борисовна Вайшля, Екатерина Борисовна Кудряшова, Елена Викторовна Арискина, Татьяна Николаевна Абашина, Михаил Борисович Вайнштейн (Автор)

Это произведение доступно по лицензии Creative Commons «Attribution-NonCommercial» («Атрибуция — Некоммерческое использование») 4.0 Всемирная.