Промышленная микробиологическая биотехнология сегодня: обзор основных продуктов
- Организации
-
- 1. Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН ФИЦ ПНЦБИ РАН
- Опубликован:
- 2025-03-30
- Ключевые слова:
- промышленная биотехнология; микробиология; липид; биополимер; фермент; аминокислота; органическая кислота; антибиотик; витамин; гормон
Аннотация
Промышленная микробиологическая биотехнология представляет собой одно из ключевых направлений современной экономики, которое активно развивается в России и мире. Она ориентирована на применение биологических процессов и различных организмов, в том числе бактерий, грибов, микроводорослей и их метаболитов, для решения значимых экономических и экологических задач. Данная отрасль охватывает производство разнообразных продуктов, которые находят широкое применение в медицинской, сельскохозяйственной и пищевой промышленности, а также в сфере производства биотоплива и биоматериалов. Настоящий обзор посвящён анализу основных продуктов промышленной микробной биотехнологии. Особое внимание уделяется современным достижениям в области производства биополимеров, ферментов, липидов, антибиотиков, аминокислот и других продуктов, получаемых с использованием микроорганизмов.
Полный текст
Оглавление
Введение
1. Биополимеры и области их применения
1.1 Биополимеры, продуцируемые бактериями
1.2 Биополимеры, продуцируемые грибами и дрожжами
1.3. Биополимеры, продуцируемые водорослями
2. Классификация ферментов и их применение в промышленной биотехнологии
2.1. Ферменты, продуцируемые бактериями
2.2. Ферменты, продуцируемые грибами
2.3. Ферменты, продуцируемые микроводорослями
2.4. Протеазы
2.5. Липазы
2.6. Амилазы
2.7. Пуллуланазы
2.8. Пектиназы
2.9. Ксиланаза
2.10. Лакказы
2.11. Трансглутаминазы
2.12. Фитазы
2.13. Ксилозоизомераза
3. Аминокислоты и их получение методами промышленной биотехнологии
3.1. Получение аминокислот
3.2. Аминокислоты, продуцируемые бактериями
4. Органические кислоты и области их применения
4.1. Бактерии — продуценты органических кислот
4.2. Грибы — продуценты органических кислот
4.3. Дрожжи — продуценты органических кислот
4.4. Микроводоросли — продуценты органических кислот
5. Получение липидов
5.1. Бактериальные и дрожжевые липиды
5.2. Грибные липиды
5.3. Липиды микроводорослей
5.4. Экстракция липидов
6. Антибиотики как продукт промышленной биотехнологии
6.1. Классификация антибиотиков
6.1.1. β-лактамные антибиотики
6.1.2. Макролиды
6.1.3. Тетрациклины
6.1.4. Аминогликозиды
6.1.5. Пептидные антибиотики
6.2. Основные этапы биотехнологического производства антибиотиков
7. Витамины, получаемые посредством микробного синтеза
7.1. Бактерии как источники витаминов
7.2. Роль грибов в производстве витаминов
7.3. Продукция витаминов микроводорослями
8. Гормоны, получаемые посредством микробного синтеза
8.1. Синтез гормонов и стероидов с использованием бактерий
8.2. Биотехнологический синтез гормонов грибами
8.3. Водоросли как источник гормонов и стероидов
Заключение
Конфликт интересов
Список литературы
Введение
Промышленная биотехнология является одним из ключевых направлений современной науки и экономики, развивающихся на стыке биологии, химии и инженерных технологий. Она основана на использовании биологических процессов и организмов, таких как бактерии, грибы, микроводоросли, а также их метаболитов для решения актуальных экономических и экологических задач.
Глобальный рынок промышленной биотехнологии в 2020 году оценивался в более чем 400 миллиардов долларов США и в дальнейшем ожидается его рост в среднем на 7-10% в ближайшие годы [1]. Основные сегменты мирового рынка промышленных биотехнологий включают такие направления как биофармацевтика (производство лекарственных средств с использованием микроорганизмов и клеток), биополимеры (использование природных источников для создания экологически чистых упаковочных материалов), биотопливо (производство биоэтанола и биодизеля для замены ископаемых видов топлива) и промышленные ферменты, применяющиеся в пищевой, фармацевтической и косметической отраслях [2]. Биотехнологический рынок в России значительно отстает от мировых показателей, однако он продемонстрировал положительную динамику за последние годы. Российский рынок биотехнологий составляет около 35-40 миллиардов рублей, и его рост ожидается на уровне 19-22% в ближайшие пять лет [3]. Несмотря на рост, российская биотехнологическая отрасль сталкивается с рядом проблем, а именно: нехватка инвестиций, высокие барьеры для выхода на рынок и недостаточная кооперация между научными учреждениями и промышленностью [4]. Основным вызовом остаётся необходимость создания эффективной нормативной базы, также необходим поиск стратегий для привлечения инвестиций.
Процессы промышленной биотехнологии можно разделить на две основные группы: производство биомассы и получение продуктов метаболизма, однако эта классификация не учитывает их ключевые технологические особенности. Важно анализировать стадии биотехнологического производства с учётом поставленной цели. На Рисунке 1 представлена схема биотехнологического производства.
Первый этап процесса биотехнологического производства состоит в выборе эффективного продуцента посредством скрининга штаммов из окружающей среды. Возможно также использование современных технологий, таких как CRISPR/Cas9 и генная инженерия, позволяющих модифицировать метаболизм микроорганизмов для повышения их способности к синтезу специфических соединений, таких как антибиотики или биополимеры [5]. Следующий этап — это ферментация, которая включает использование микроорганизмов для превращения углеродных источников в различные продукты, такие как ферменты, кислоты, спирты и полимеры. В качестве примера можно привести использование Saccharomyces cerevisiae для производства этанола из сахаров. При этом необходимо обеспечить оптимальные условия для культивирования бактерии-продуцента (температура, pH и соотношение субстратов), которые критически важны для получения желаемого выхода целевого продукта [6]. Одним их важных экономических составляющих промышленного ферментационного процесса является использование недорогих и возобновляемых источников углерода, например, сельскохозяйственные отходы или промышленные побочные продукты. Так в работе Khan, M. I. с соавторами, продемонстрировано, что бактерии родов Rhodococcus и Pseudomonas, могут использовать растительные отходы для производства биопластиков и биотоплива, что снижает стоимость продукции и улучшает экологическое состояние окружающей среды [7]. Кроме того, современные биореакторы всегда оснащены датчиками контроля различных параметров культивирования, что также способствует максимизации выхода целевых продуктов и обеспечивает высокую эффективность процессов. López N.I. c соавторами в процессе непрерывного культивирования за счет оптимизации параметров роста культуры смогли увеличить выход продукции полигидроксиалканоатов [8]. На заключительном этапе промышленного производства необходимо провести эффективное извлечение и очистку целевых продуктов с использованием различных методов, таких как центрифугирование, осаждение и хроматография [9].
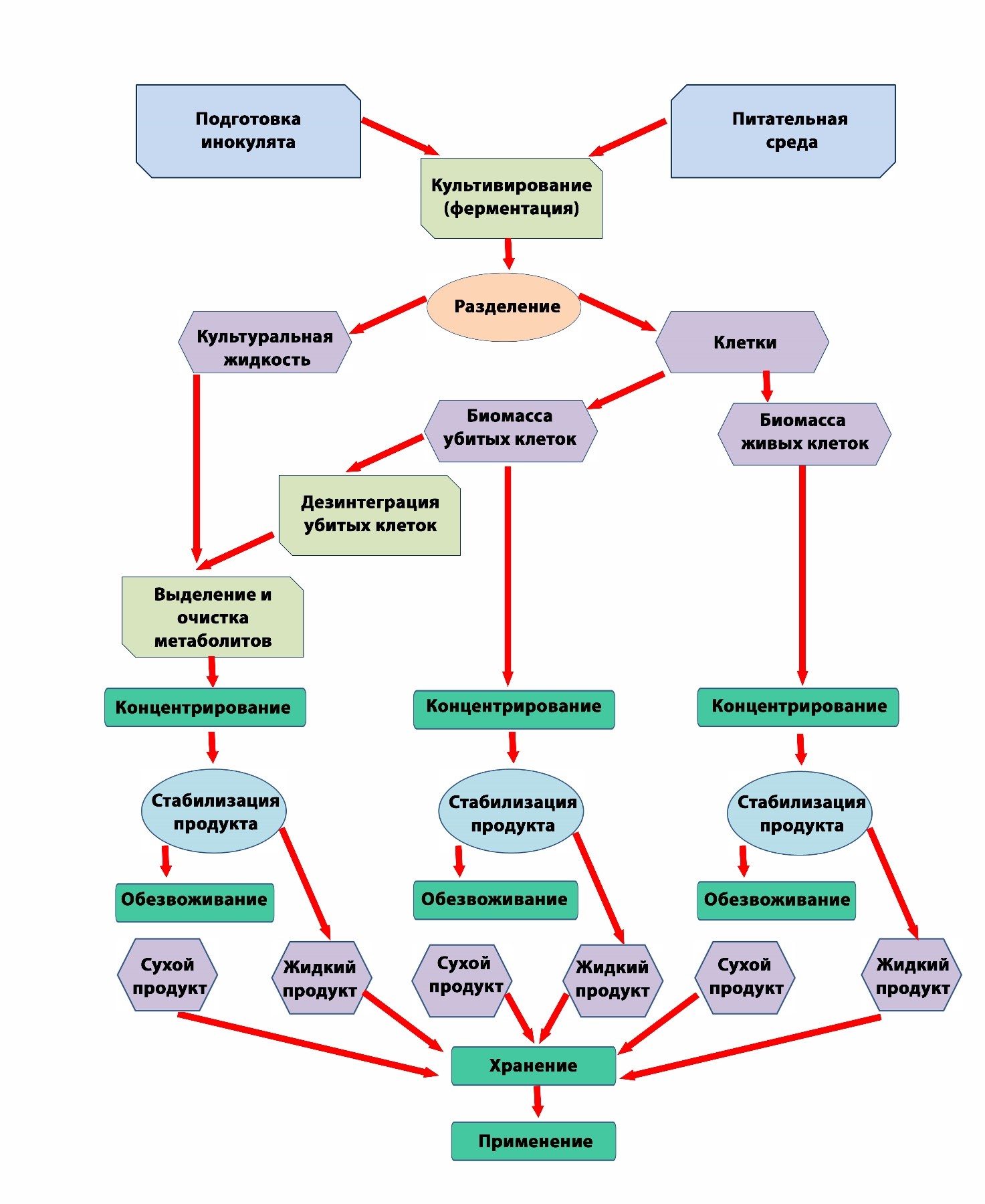
Рисунок 1. Схема биотехнологического производства.
Промышленная биотехнология имеет огромный потенциал для решения глобальных проблем, таких как обеспечение продовольственной безопасности, развитие экологически чистых источников энергии и создание новых материалов с улучшенными свойствами. Однако для полного раскрытия этого потенциала необходимо проведение дальнейших исследований и разработок, а также создание благоприятных условий для внедрения биотехнологических решений в практику. Современные достижения в области молекулярной биологии, генетической инженерии и микробиологии открывают новые горизонты для создания инновационных продуктов, которые находят применение в медицине, сельском хозяйстве, экологии, пищевой промышленности и энергетике. В данном обзоре рассматриваются основные типы продуктов промышленной биотехнологии, которые находят применение в различных сферах деятельности человека. Особое внимание уделяется биополимерам, ферментам, биологически активным веществам и другим продуктам, производимым с помощью биотехнологических методов.
Продукты промышленной биотехнологии можно классифицировать разными способами, например, в зависимости от типа выпускаемых продуктов, источника получения, либо отрасли применения. В данном разделе будут представлены следующие разновидности продуктов промышленной биотехнологии: биополимеры, ферменты, аминокислоты, органические кислоты, липиды, антибиотики, витамины и гормоны.
1. Биополимеры и области их примененияБиополимеры, синтезируемые микроорганизмами, представляют собой важный класс материалов, которые находят широкое применение в различных отраслях промышленности, включая медицину, пищевую промышленность, сельское хозяйство и биотехнологии. Полигидроксиалканоаты, экзополисахариды, хитозан, альгинаты и другие полимеры обладают уникальными свойствами, включая биосовместимость, биоразлагаемость и возможность производства из возобновляемых ресурсов.
1.1. Биополимеры, продуцируемые бактериямиБактерии являются одним из наиболее изученных источников биополимеров благодаря их способности к высокому уровню биосинтеза в строго контролируемых условиях.
Полигидроксиалканоаты насчитывают более 150 разновидностей и являются одним из наиболее изученных классов биополимеров, синтезируемых бактериями Cupriavidus necator, Schelegelella thermodepolymerans, Pseudomonas spp., Ralstonia eutropha и Bacillus spp. Полигидроксиалканоаты накапливаются в клетках микроорганизмов в качестве запасающих материалов в условиях дефицита питательных веществ, таких как азот или фосфор, в присутствии избытка углерода [10]. Эти полимеры могут использоваться для производства упаковочных материалов, медицинских имплантатов, биоразлагаемых пленок и сельском хозяйстве [11, 12]. Промышленное производство полигидроксиалканоатов осуществляется на предприятиях в Бразилии, Австрии и Китае с использованием различных органических субстратов, включая отходы сельского хозяйства.
Экзополисахариды, такие как ксантан и гиалуроновая кислота, продуцируются бактериями родов Xanthomonas, Leuconostoc и Streptococcus. Ксантан, получаемый аэробной ферментацией сахаров, широко используется в пищевой промышленности в качестве загустителя и стабилизатора, а гиалуроновая кислота находит применение в косметике и медицине благодаря своим увлажняющим и регенерирующим свойствам [13]. Декстран и леван, синтезируемые бактериями родов Leuconostoc, Lactobacillus, Streptococcus, Aerobacter и Weissella [14], применяются в фармацевтической индустрии, включая производство плазмозаменителей и систем замедленного высвобождения лекарств [15]. Экзополисахарид курдлан получают путем глубинной ферментации бактерий родов Rhizobium, Agrobacterium, Alcaligenes, Cellulomonas, и Bacillus [16]. Его способность к желированию обусловливает его применение в пищевой индустрии и биомедицинских исследованиях.
1.2. Биополимеры, продуцируемые грибами и дрожжамиДрожжи широко используются в производстве таких полисахаридов, как β-глюканы и маннаны.
Хитозан, производное хитина, синтезируется такими грибами, как Aspergillus niger и Mucor rouxii. Этот биополимер обладает антимикробными, антиоксидантными и биосовместимыми свойствами, что делает его перспективным для использования в медицине, например, для создания раневых покрытий и доставки лекарств [17].
β-глюканы, продуцируемые дрожжами Saccharomyces cerevisiae, Candida albicans и Kluyveromyces lactis и грибами Pleurotus ostreatus, обладают иммуномодулирующими свойствами и используются в пищевых добавках и фармацевтике для укрепления иммунной системы [18].
Маннан-олигосахариды, синтезируемые дрожжами S. cerevisiae, используются в качестве пребиотиков в кормах для животных для улучшения кишечного здоровья и иммунного ответа [19].
Фуцин синтезируется некоторыми видами грибов, включая представителей родов Fusarium и Aspergillus. Это соединение образуется в процессе метаболизма грибов и выделяется в окружающую среду в виде экзополисахарида. Производство фуцина зависит от условий культивирования, таких как состав питательной среды, pH, температура и аэрация [20]. Оптимизация этих параметров позволяет увеличить выход биополимера и сделать его производство экономически выгодным для промышленности [21]. Фуцин представляет собой экологически безопасный и биоразлагаемый материал, что делает его привлекательным для использования в различных областях, включая медицину (например, создание биоразлагаемых пленок и систем доставки лекарств) и сельское хозяйство (например, производство биоразлагаемых упаковочных материалов) [22].
Пуллулан в основном получают как водорастворимый полисахарид из дрожжеподобного гриба Aureobasidium pullulans. Другими известными грибами, производящими пуллулан, являются Tremella mesenterica, Cryphonectria parasitica, Teloschistes flavicans, Rhodotorula bacarum, Cytaria harioti и C. Darwinii [23]. Пуллулан нашел обширное применение в различных отраслях, включая фармацевтику, косметологию, биомедицину и пищевую индустрию. Высоко востребован он и для производства бумаги, что обусловлено его клеящими свойствами.
1.3. Биополимеры, продуцируемые водорослямиАльгинаты, синтезируемые бурыми водорослями (например, Laminaria spp.), широко используются в пищевой промышленности в качестве загустителей и стабилизаторов, а также в фармацевтике для создания гидрогелей и раневых покрытий [24].
Каррагинаны, получаемые из красных водорослей (например, Chondrus crispus), применяются в пищевой промышленности для улучшения текстуры продуктов, а также в фармацевтике для создания лекарственных форм и микрокапсул [25]. Промышленное производство альгинатов и каррагинанов активно развивается в странах с богатой аквакультурой, таких как Индонезия и Норвегия.
Благодаря своим уникальным свойствам и возможности производства из возобновляемых ресурсов, биополимеры способствуют снижению зависимости от ископаемых ресурсов и уменьшению негативного влияния на экологию. В целом, промышленное производство биополимеров требует оптимизации условий культивирования микроорганизмов, включая выбор штаммов, состав питательной среды, pH, температуру и аэрацию. Современные биотехнологические подходы, такие как метаболическая инженерия и CRISPR/Cas9, позволяют повысить продуктивность микроорганизмов и снизить стоимость производства [26]. Кроме того, дальнейшие исследования в области метаболической инженерии и оптимизации процессов производства позволят расширить области применения биополимеров и сделать их более доступными для промышленного использования.
2. Классификация ферментов и их применение в промышленной биотехнологииТребования экологической безопасности к большинству промышленных процессов постоянно растут. Под давлением этих требований происходит замена некоторых химических катализаторов, используемых в промышленности, на ферменты, преимущественно микробиологического происхождения. Это связано с экономическими аспектами ферментационного процесса. Микробные ферменты часто имеют ряд преимуществ по сравнению с ферментами растительного и животного происхождения, например большое разнообразие микробных продуцентов, простота производства ферментных продуктов в ферментерах, возможность непрерывного получения целевого продукта, а также легкость управления процессом и т.д.
Несмотря на давнюю историю применения ферментных технологий, широкомасштабное производство ферментов в виде очищенных и хорошо охарактеризованных препаратов стало возможным только с развитием технологии рекомбинантных ДНК. Они стали широко использоваться в химической, моющей, текстильной, пищевой, кормовой, кожевенной и целлюлозно-бумажной промышленности.
Развитие таких методов, как белковая инженерия и сайт-ориентированный мутагенез, дает возможность создавать ферменты с новыми свойствами [27].
Технологии промышленного производства ферментов микроорганизмами на различаются в зависимости от типа используемого продуцента.
2.1. Ферменты, продуцируемые бактериямиБактерии Bacillus subtilis, Bacillus licheniformis и Escherichia coli часто используются для получения таких ферментов, как амилазы, протеазы и липазы [28]. Производство чаще всего проводится методом субмерсной ферментации, где клеточная масса культивируется в жидкой питательной среде при высоком уровне аэрации. Этот метод обеспечивает быстрый рост бактерий и высокий выход фермента [29]. Для выделения фермента зачастую используется центрифугирование и осаждение белков.
2.2. Ферменты, продуцируемые грибамиПоловина из коммерчески производимых ферментов имеют грибное происхождение. Это обусловлено простотой культивирования грибов в биореакторах и высоким выходом продукции [30]. Грибы Aspergillus niger, Trichoderma reesei и Penicillium spp., являются основными продуцентами ферментов целлюлазы, пектиназы и амилопектиназы [31]. Производятся ферменты чаще всего методом поверхностной ферментации на твёрдых питательных средах, таких как пшеничные отруби или рисовые оболочки. Этот метод эффективен для получения экзоферментов, которые выделяются во внешнюю среду [32]. Также распространён метод субмерсной ферментации для грибов, культивируемых в жидких средах с высоким содержанием углеводов [33].
2.3. Ферменты, продуцируемые микроводорослямиМикроводоросли, такие как Chlorella vulgaris и Spirulina platensis, используются для получения липаз и фосфатаз [34]. Ферменты получают в открытых или закрытых фотобиореакторах, где продуценты растут в жидких средах, где поддерживаются оптимальные условия. Поскольку некоторые водоросли являются автотрофами, их способность продуцировать ферменты зависит от интенсивности света и доступности CO2, что требует использования специфических биореакторов [35].
Появление новых областей применения ферментов приводит к увеличению спроса на промышленные ферменты, и промышленность отвечает на это постоянным появлением инновационных продуктов. Среди промышленных ферментов, используемых в настоящее время, наиболее распространены гидролазы, такие как протеазы и липазы, которые широко используются в различных отраслях, например в производстве моющих средств, молочной и химической промышленности. Важной группой ферментов также являются карбогидразы, в частности амилазы и целлюлазы [36-37].
Ферменты можно классифицировать в соответствии с основным направлением применения: технические ферменты (применяемые в производстве синтетических моющих средств; в текстильной, кожевенной, целлюлознобумажной промышленности; в производстве биотоплива); ферменты для пищевой промышленности и производства напитков; кормовые ферменты [38]. В таблице 1 приведены ферменты, наиболее часто используемые в различных областях промышленности.
2.4. ПротеазыПротеазы (протеиназы, протеолитические ферменты) представляют собой группу ферментов, способных гидролизовать пептидные связи в белках. Они делятся на экзопептидазы (расщепляющие концевые пептидные связи) и эндопептидазы (действующие внутри белков). Протеазы классифицируются по субстратной специфичности, каталитическому механизму, рН-оптимуму и другим свойствам.
Субтилизины — сериновые протеазы, активно используются в производстве моющих средств, благодаря стабильности и низкой субстратной специфичности [40]. Производимые бактериями рода Bacillus, они обладают активностью в диапазоне pH 6–11, с оптимумом 9–11. В 1985 году был создан первый генетически модифицированный субтилизин, менее чувствительный к окислению перекисью водорода [41]. Последующие исследования позволили улучшить свойства субтилизинов: термостабильность, активность в органических растворителях и экстремальных pH [42]. Протеазы нашли применение в пищевой промышленности для гидролиза белков и получения питательных белковых гидролизатов [43]. Кислые протеазы, используемые в молочной промышленности, заменяют сычужный фермент при производстве сыра [44]. Щелочные протеазы применяются для переработки отходов, таких как кератиновые материалы, и получения кормов [45]. В кожевенной промышленности они заменяют химические вещества для замачивания шкур и удаления волос, что снижает загрязнение и энергозатраты [46]. Исследования протеаз в основном направлены на создание новых ферментов с улучшенными характеристиками и новыми областями применения. Эти работы играют важную роль для совершенствования промышленных процессов [47-48].
2.5. ЛипазыЛипазы катализируют гидролиз триглицеридов до глицерина и жирных кислот и широко распространены в природе. Они обладают каталитической триадой (серин, гистидин, аспартат) и межфазной активацией, что позволяет им быть высокоэффективными на гидрофобных поверхностях [49]. Липазы также участвуют в процессах этерификации и трансэтерификации, что делает их востребованными в пищевой промышленности, производстве биотоплива, моющих средств и органической химии [50-51].
В пищевой промышленности липазы трансэтерифицируют пальмовое масло для создания заменителей какао-масла, синтезируют вкусо-ароматические соединения, удаляют фосфолипиды и создают низкокалорийные продукты. Иммобилизованные липазы снижают затраты на производство за счет многоразового использования [52]. При производстве моющих средств их применяют для удаления жировых пятен, обычно используя ферменты, устойчивые к щелочной среде, например, липазы Thermomyces lanuginosus и Pseudomonas mendocina [53]. В кожевенной промышленности липазы используются в процессе обезжиривания кож с пониженным ущербом для окружающей среды [54].
Таблица 1. Ферментные препараты и области их использования [39].
|
Фермент, класс (ЕС) |
Источник получения |
Сфера применения |
|
Глюкозооксидаза (EC 1.1.3.4) |
Aspergillus spp. |
Производство моющих средств, хлебопекарное производство |
|
Лакказа (EC 1.10.3.2) |
Myceliophthora spp., Trametes spp., Thielavia spp. |
Производство моющих средств, текстильная промышленность |
|
Каталаза (EC 1.11.1.6) |
Aspergillus spp., Scytalidium spp., Thermoascus spp. |
Текстильная промышленность |
|
Липаза (EC 3.1.1.3) |
Aspergillus spp., Candida spp., Fusarium spp., Humicola spp., Rhizomucor spp., Thermomyces spp. |
Производство моющих средств, кожевенная промышленность, целлюлознобумажная промышленность, биокатализ, хлебопекарная промышленность, молочная и масложировая промышленности. |
|
Пектиназа (EC 3.1.1.11; EC 3.2.1.15; ЕС 4.2.2.10) |
Aspergillus spp. |
Производство соков и вин |
|
Фосфолипаза (EC3.1.1.32; EC3.1.4.1) |
Aspergillus spp., Fusarium spp., Thermomyces spp. |
Модификация жиров |
|
Гемицеллюлаза (EC 3.1.1.73) |
Aspergillus spp. |
Производство соков и вин |
|
Фитаза (ЕС 3.1.3.8; ЕС 3.1.3.26) |
Aspergillus spp., Peniophora spp. |
Производство кормов |
|
ɑ-амилаза (ЕС 3.2.1.1) |
Aspergillus spp., Thermoactinomyces spp. |
Целлюлозно-бумажная промышленность, хлебопекарная промышленность, пивоваренная промышленность, производство соков и вин |
|
Амилоглюкозидаза, глюкоамилаза (EC 3.2.1.3) |
Aspergillus spp., Talaromyces spp., Trichoderma spp. |
Производство моющих средств, производство биотоплива, производство подсластителей, производство соков и вин |
|
Целлюлаза (EC 3.2.1.4; EC 3.2.1.91) |
Humicola spp., Myceliopthora spp., Thielavia spp. |
Производство моющих средств, текстильная промышленность, производство биотоплива, целлюлозно-бумажная промышленность |
|
β-глюканаза (EC 3.2.1.6) |
Thermoascus spp., Trichoderma spp. |
Производство кормов, производство биотоплива, пивоваренная промышленность |
|
Ксиланаза (EC 3.2.1.8) |
Actinomadura spp., Aspergillus spp., Thermomyces spp., Trichoderma spp. |
Целлюлозно-бумажная промышленность, хлебопекарная промышленность, пивоваренная промышленность, производство кормов |
|
Лактаза |
Aspergillus spp., Kluyveromyces spp. |
Молочная промышленность |
|
Пуллуланаза |
Hormoconis spp. |
Производство биотоплива, производство спирта |
|
Протеаза |
Aspergillus spp., Cryphonectria spp., Fusarium spp., Rhizomucor spp., Trichoderma spp. |
Мясная и молочная промышленность, кожевенная промышленность, производство моющих средств, средства для стирки посуды, пищевая промышленность, |
При производстве биодизеля липазы выступают экологичной альтернативой химическим катализаторам, обеспечивая чистоту продукта и эффективное отделение глицерина. Их высокая стоимость частично компенсируется использованием иммобилизованных ферментов, рекомбинантной ДНК и белковой инженерии [54-55]. Липазы также востребованы в фармацевтике и агрохимии для синтеза хиральных соединений.
2.6. АмилазыАмилазы (гликозидгидролазы) гидролизуют α-1,4-гликозидные связи в крахмале, разлагая его до сахаров. Микробные амилазы делятся на экзо- (глюкоамилазы и β-амилазы) и эндоамилазы (α-амилазы). Глюкоамилазы гидролизуют α-1,4 и α-1,6 связи, высвобождая глюкозу, а β-амилазы — мальтозу [56]. Эндоамилазы разрушают внутренние связи в крахмале, образуя олигосахариды. Альфа-амилазы, термостабильные ферменты, получаемые из грибов и бактерий, применяются в пищевой, текстильной, бумажной и ферментационной промышленности [57-58]. Амилазы востребованы благодаря своей стабильности, активности при экстремальных условиях. Например, штаммы Bacillus sp. (B. subtilis, B. licheniformis) производят ферменты, активные в диапазоне рН 1,0–11,5 и температур 25–90 °C, что подходит для промышленных процессов.
Амилазы применяются для ферментативного разжижения и осахаривания крахмала, заменяя менее эффективный кислотный гидролиз. Амилазы используются и в производстве этанола: α-амилазы разлагают крахмал до сахаров, которые затем ферментируются в этанол грибами S. cerevisiae. В моющих средствах α-амилазы помогают удалять крахмал даже при низких температурах [58].
В бумажной промышленности α-амилазы, такие как Амизим® и Термамил®, снижают вязкость крахмала для проклеивания бумаги, что улучшает ее жесткость и качество. В хлебопечении ферменты разлагают крахмал на декстрины, что увеличивает объем, улучшает текстуру, вкус, цвет и продлевает срок хранения хлеба [59].
2.7. ПуллуланазыПолисахариды, такие как крахмалы, представляют собой полимеры D-глюкопиранозы с α-1,4 связями и разветвлениями α-1,6. Для полного гидролиза крахмала требуются ферменты, способные расщеплять оба типа связей. Пуллуланазы, широко распространенные в природе, гидролизуют α-1,6 связи, разрушая разветвления в крахмале, амилопектине и гликогене. Пуллуланазы I типа (ферменты для удаления разветвлений) действуют только на α-1,6 связи, а пуллуланазы II типа (амилопуллуланазы) способны гидролизовать как α-1,6, так и α-1,4 связи [60]. Например, в пищевой промышленности пуллуланазы используются для образования мальтотриозного сиропа, обладающего мягкой сладостью, низкой температурой замерзания и свойствами удержания влаги. Такой сироп применяется в производстве десертов, выпечки, пива и фармацевтических продуктов, включая растворы для внутривенного введения.
2.8. ПектиназыПектиназы (пектинолитические ферменты) гидролизуют пектиновые вещества — полисахариды растений с каркасом из α-D-галактуронатных звеньев, связанных с α-1,4. Они делятся на три группы: протопектиназы (превращают нерастворимый протопектин в растворимый пектин), эстеразы (удаляют метоксиэфиры) и деполимеразы (разрушают α-1,4-связи в пектине) [61]. Наиболее распространенное применение пектиназ — экстракция и осветление фруктовых соков, где они разлагают пектины, облегчая прессование, получение чистого сока и удаление мути. Для повышения эффективности этого процесса используются также целлюлазы и ксиланазы [62].
Пектиназы активно применяются в текстильной промышленности, где совместно с другими ферментами (амилазы, липазы) они удаляют проклеивающие вещества перед окрашиванием тканей, снижая необходимость использования агрессивной химии [63]. Кроме того, ферменты используются для обработки хлопка, заменяя щелочную обработку на более экологичное биопекарирование, что улучшает водопоглощение и сохраняет волокна. В лубяных волокнах пектиназы в комбинации с ксиланазами эффективно удаляют камедь, уменьшая экологический ущерб.
Пектиназы также применяются для ферментативной обработки сточных вод растительной пищевой промышленности, способствуя их разложению [64]. В кормовых добавках ферменты увеличивают усвояемость питательных веществ у животных и сокращают отходы. Для оптимизации применения пектиназ необходимы дальнейшие исследования их устойчивости, специфичности и свойств.
2.9. КсиланазаРастительная биомасса содержит около 23% лигнина, 40% целлюлозы и 33% гемицеллюлозы, включая ксилан. Ксилан представляет собой гетерополимер с D-ксилозой в основе, разветвленной L-арабинозой и глюкуроновой кислотой. Для его гидролиза требуется комплекс ферментов, таких как эндоксиланазы, β-ксилозидазы, эстеразы и др. Эндоксиланазы расщепляют основную цепь ксилана, а β-ксилозидазы превращают ксилоолигосахариды в ксилозу. Ксиланазы активно производятся грибами родов Aspergillus и Trichoderma [65].
Основное применение ксиланаз — в целлюлозно-бумажной промышленности для удаления лигнина из крафт-целлюлозы, что снижает использование хлорных отбеливателей и повышает качество целлюлозы. Ферменты также используются для улучшения свойств теста в хлебопечении, увеличения объема хлеба и продления его свежести [66]. При производстве кормов для животных ксиланазы гидролизуют арабиноксиланы в злаках, уменьшая их вязкость в кишечнике и улучшая набор веса животных [67].
В сельском хозяйстве и пищевой промышленности ксиланазы перерабатывают отходы, превращая ксилан в ксилозу, которая может быть использована в сточных водах или для получения олигосахаридов. Эти ферменты также способствуют синтезу фитостеролов, фитоалексинов и алкилгликозидов, применяемых в качестве поверхностно-активных веществ [68].
2.10. ЛакказыЛакказы, также известные как ферменты бензендиол-оксидоредуктазы кислорода, обладают способностью окислять множество органических субстратов, включая орто- и пара-дифенолы, аминофенолы, полифенолы, полиамины, лигнины и арилдиамины, а также некоторые неорганические ионы. Молекула лакказы представляет собой гликопротеин, обычно димерный или тетрамерный, с четырьмя атомами меди на каждом мономере, распределенными в трех центрах окислительно-восстановительных реакций. Лакказы широко применяются в биообесцвечивании, делигнификации целлюлозы, удалении красителей и загрязнителей, создании биосенсоров, биотопливных ячеек, а также в пищевой и текстильной промышленности [69].
В целлюлозно-бумажной промышленности они обеспечивают экологически безопасную делигнификацию и осветление без применения хлора. В текстильной индустрии лакказы используются для разложения синтетических красителей и отбеливания тканей. В биоремедиации они разлагают ксенобиотики, включая полициклические углеводороды [69].
В пищевой промышленности лакказы применяются для удаления фенолов из напитков (соки, пиво, вино), улучшая их прозрачность. Они также влияют на свойства теста, повышая его стойкость за счет сшивания биополимеров [69].
2.11. ТрансглутаминазыТрансглутаминазы это семейство ферментов, участвующих в каталитическом образовании ковалентной связи между свободной аминогруппой лизина (ацильный акцептор) и гамма-карбоксамидной группой глутамина (ацильный донор) в белках и пептидах. Это приводит к модификации белков путем их сшивания внутри- или межмолекулярно, что в свою очередь улучшает конечное использование белка [70]. Кроме сшивания, трансглутаминазы также способны к катализу дезаминирования глутаминовых остатков, которые являются акцепторами аминогрупп. В отсутствие субстратов с аминогруппами, молекулы воды могут выступать в качестве акцепторов для дезаминирования остатков глутамина. Трансглутаминазы встречаются в животных, растениях, микроорганизмах и различаются по размеру и зависимости от кальция: ферменты млекопитающих требуют кальция, а микробные нет [70].
В пищевой промышленности трансглутаминазы улучшают свойства белков (молочных, соевых, мясных, рыбных), повышая их пищевую ценность, эластичность и влагосодержание. Эти ферменты также используются для создания термостойких пленок и увеличения срока хранения продуктов за счет защиты лизиновых остатков [71]. Кроме того, трансглутаминазы находят применение в текстильной промышленности для улучшения качества шерсти [72].
2.12. ФитазыФитазы (фосфатазы) играют важную роль в гидролизе фитата и обеспечивают доступность фосфата для различных организмов [73]. Фитазы могут быть разделены на несколько групп в зависимости от содержания углерода в кольце миоинозитола фитата [73]. Некоторые из них также могут называться фитазами гистидиновой кислоты, α-пропеллерными фитазами, цистеиновыми фитазами или фитазами пурпурной кислоты на основе их каталитического механизма [73]. Фитазы широко применяются в кормах для животных (свиней, птицы, рыбы), увеличивая усвоение фитат-фосфора на 20–45% и снижая потребность в неорганическом фосфоре [73]. Это уменьшает фосфатное загрязнение окружающей среды и снижает затраты производителей кормов [74-75].
Фитазы могут применяться в хлебопечении, производстве растительных белков, кукурузном помоле и пищевых добавках. Они также перспективны для создания функциональных продуктов питания.
2.13. КсилозоизомеразаКсилозоизомераза — фермент, который катализирует обратимую изомеризацию D-глюкозы в D-фруктозу, а также D-ксилозы в D-ксилулозу. Этот фермент относится к классу изомераз и обнаружен почти у 100 видов бактерий. Производство глюкозных сиропов началось в России в 1811 году, когда немецкий химик Константин Кирхгоф из Императорской Академии наук в Санкт-Петербурге получил глюкозный сироп путем нагревания крахмала с серной кислотой [76]. Уже в середине XX века ключевую роль сыграло открытие фермента ксилозоизомеразы, превращающего глюкозу во фруктозу. Такасаки из Японского института ферментации выявил термостабильную ксилозоизомеразу из Streptomyces, что стало основой для коммерческого производства сиропов с высоким содержанием фруктозы [77]. В 1967 году компания Clinton Corn Processing (США) внедрила японскую технологию для производства глюкозо-фруктозных сиропов (ГФС), а затем усовершенствовала процесс, используя иммобилизацию фермента, что позволило получить сироп с 42% фруктозы [77]. Для дальнейшего увеличения концентрации фруктозы использовали хроматографическое разделение. ГФС с высоким содержанием фруктозы нашли применение как сахарозаменители в продуктах [78-79]. Развитие технологий продолжается в направлении снижения производственных затрат [80].
В настоящее время ферменты, работающие в мягких условиях, активно используются в промышленности и других процессах благодаря своим эффективным каталитическим свойствам. Однако, в свете новых достижений в области белковой инженерии и направленной эволюции можно ожидать появления новых ферментов с улучшенными характеристиками, которые будут применяться как в уже существующих технических сферах, так и в полностью новых областях, где использование ферментов ранее было невозможно.
3. Аминокислоты и их получение методами промышленной биотехнологииС начала XX века спрос на аминокислоты продолжает расти, благодаря их роли в синтезе белков и участии в метаболизме. Эти соединения широко используются в пищевой, фармацевтической, косметической индустрии и сельском хозяйстве, улучшая ферментативную активность, иммунитет и мышечный метаболизм [81-83]. Дефицит аминокислот может вызывать серьезные заболевания [84-85].
Новейшие достижениям в области генной инженерии позволили получать высококачественные продукты с необходимыми свойствами [86]. Открытия в этой области привели к разработке новаторских методик выделения аминокислот, включая ферментации с использованием микробных культур, экстракцию из гидролизатов белков и химический синтез. Такие методы позволяют создавать экологичные продукты для питания и сельского хозяйства [86]. Рост интереса к аминокислотам стимулирует развитие инновационных и безопасных для природы технологий.
Кикунаэ Икеда, исследовавший глутамат натрия в 1907 году, открыл путь к коммерческому производству усилителей вкуса и положил начало исследованиям в этой сфере. Сегодня аминокислоты применяются в разнообразных областях, включая пищевые и кормовые добавки, косметику, полимеры и химические вещества. Основной задачей остается оптимизация методов их промышленного синтеза для повышения эффективности и устойчивости [87].
3.1. Получение аминокислотСуществует три основных подхода к получению аминокислот: экстракция из белковых гидролизатов, химический синтез и микробиологические технологии.
Экстракция из белковых гидролизатов основана на уникальных характеристиках аминокислот, таких как уровень pH, и используется для выделения, например, L-цистеина из кератинсодержащих материалов (волосы, перья). Этот метод эффективен и экономичен, так как использует отходы промышленности [88]. Экстракция с применением щелочи ведёт к ущербу для окружающей среды из-за образования сточных вод с токсичными соединениями [89]. Разработка методов с использованием сверхкритической воды позволила улучшить результаты, минимизируя негативное воздействие на окружающую среду [90-91]. Однако ресурсная ограниченность белковых материалов остается проблемой.
Химический синтез включает реакции, такие как метод Штрекера, однако катализаторы дороги, используемые соединения токсичны (например, цианид), а энантиоселективность отсутствует [92-93]. Известный метод Бухерера-Бергса используется для синтеза рацемических аминокислот, но требует разделения изомеров и является энергозатратным [94].
Микробиологический синтез включает ферментацию с помощью микроорганизмов, таких как E. coli или S. cerevisiae. Этот способ позволяет получать оптически чистые аминокислоты с высокой эффективностью и низким количеством побочных продуктов [86]. Иммобилизация ферментов, как показано в ряде исследований, увеличивает стабильность процесса и выход продукта [95]. Ферментация считается наиболее экономичным и экологичным методом, несмотря на высокие затраты на аэрацию, стерилизацию и оборудование [96]. Этот подход преобладает в производстве L-аминокислот для пищевой промышленности и фармацевтики, так как обеспечивает высокую чистоту продуктов.
3.2. Аминокислоты, продуцируемые бактериямиНаиболее часто используемыми микроорганизмами для ферментации аминокислот являются представители Corynebacterium glutamicum и E. coli [86]. Генетически модифицированный Corynebacteruim glutamicum эффективно производит аминокислоты, такие как L-лизин и глутаминовая кислота, с выходом, достигающим 50% [97-98]. Этот штамм, предпочитающий глюкозу, используется для производства L-глутамата, L-лизина, L-фенилаланина, L-триптофана и других аминокислот [99-100]. Однако его рост замедляется при высоких концентрациях субстрата или продукта, например, глюкозы выше 50 г/л или L-глутаминовой кислоты выше 12 г/л [101].
E. coli используется для синтеза таких аминокислот, как L-метионин, L-лизин и L-треонин [86]. Сайт-специфичный мутагенез и модификация метаболических путей позволяют создавать штаммы для продуцирования аминокислот с разветвленной цепью, таких как L-валин, L-лейцин и L-изолейцин, что делает их перспективными для получения кормов, косметики и фармацевтики [102].
Благодаря генной инженерии стало возможным использовать отходы в качестве сырья для ферментации, что позволило сделать процесс экономичным и экологичным. Инновационные технологии, такие как нанофильтрационные мембраны для интеграции очистки и производства, а также моделирование реакторов, способствуют повышению эффективности и снижению затрат. В перспективе использование бактерий и микроводорослей для преобразования отходов в белки, богатые аминокислотами, открывает новые возможности для создания белковых добавок и устойчивого производства [86].
4. Органические кислоты и области их примененияОрганические кислоты представляют собой низкомолекулярные органические соединения, содержащие одну или несколько кислотных функциональных групп, таких как карбоксильные, сульфоновые, гидроксильные или тиольные группы. Благодаря этим функциональным группам органические кислоты служат важными строительными блоками для производства химических соединений, которые имеют широкий спектр применений на мировых рынках. Раньше такие кислоты часто получали из нефти, однако учитывая неустойчивость этого ресурса и связанные с ним значительные выбросы парниковых газов, переход на биотехнологические методы производства становится необходимым [103].
4.1. Бактерии — продуценты органических кислотБактерии являются важными продуцентами различных органических кислот. Среди наиболее изученных соединений можно выделить молочную, янтарную и уксусную кислоты.
Молочную кислоту производят различные штаммы Lactobacillus casei, а также Rhisopus oryzae и Endomycopsis fibuligera [104]. Она широко применяется в производстве биоразлагаемых пластиков (например, полилактида), а также в пищевой промышленности в качестве консерванта и регулятора кислотности.
Уксусная кислота синтезируется бактериями Acetobacterium woodi и Clostridium aceticum путем микробиологической конверсии водорода и углекислого газа [105].
Янтарная кислота (бутандиовая кислота) является важным химическим соединением, которое широко используется в различных отраслях промышленности [106]. Основными бактериями, осуществляющими синтез янтарной кислоты, являются: E. coli, Basfia succiniproducens, C. glutamicum. Эта кислота приобрела коммерческое значение как добавка к топливу и сырье для химической промышленности [107].
4.2. Грибы — продуценты органических кислотГрибы также играют значительную роль в биосинтезе органических кислот. Особенно интересны штаммы родов Aspergillus и Penicillium, которые используются для получения лимонной и щавелевой кислот.
Лимонная кислота (2-гидрокси-пропан-1,2,3-трикарбоновая кислота) является широко востребованным соединением в пищевой и фармацевтической промышленности благодаря своей безопасности, высокой водорастворимости, а также выраженным хелатирующим и буферным свойствам. Помимо этого, лимонная кислота находит широкое применение в производстве моющих средств, косметической продукции и ряде других промышленных областей [108]. Современное промышленное производство лимонной кислоты основано на использовании A. niger и различных видов Rhizopus в процессе глубинной ферментации на средах с крахмалом или сахарозой [109]. Для повышения конкурентоспособности данного производства исследователи пытаются снизить затраты путем перехода на более дешевые субстраты, такие как агропромышленные отходы [110]. Однако такие субстраты требуют предварительной обработки для обеспечения усвояемости питательных веществ, что может увеличить сложность и удорожить процесс, особенно если требуется высокая чистота продукта.
Другим примером является глюконовая кислота, синтезируемая Aspergillus spp., которая находит применение в текстильной и бумажной промышленности, а также используется в качестве средства для очистки от ржавчины [111]. Процесс производства осуществляется путем микробиологической ферментации с использованием различных источников углерода, содержащих гидролизаты глюкозы.
Итаконовая кислота представляет собой α,β-ненасыщенную двухосновную карбоновую кислоту, которая производится грибами Aspergillus itaconicus и Aspergillus terreus [112]. Данное соединение находит широкое применение в химической промышленности, преимущественно в производстве различных полимеров, включая карбоксилатные каучуки, стирен-бутадиеновые полимеры и нитрильные латексы [113]. Кроме того, итаконовая кислота служит исходным сырьем для синтеза пиролидонов, бутиролактона, метилбутандиола, а также используется в производстве детергентов, гербицидов и растворителей [114].
Фумаровая кислота является транс-изомером бутендиовой кислоты, которая производится различными представителями мукоровых грибов, включая рода Mucor, Rhizopus и Cunninghamella [115]. Этот биотехнологический процесс основан на способности данных микроорганизмов осуществлять конверсию углеводов в фумаровую кислоту через метаболические пути трикарбоновых кислот. Получаемая фумаровая кислота находит широкое применение в различных отраслях: пищевой промышленности (пищевые добавки, ароматизаторы), фармацевтике (промежуточные продукты синтеза), косметике (регуляторы кислотности) и химической промышленности (производство полимеров). Фумаровая кислота используется для получения малеиновой кислоты, которая применяется в производстве смол, красок и лаков [115].
4.3. Дрожжи — продуценты органических кислотСуществуют различные виды дрожжей, способные к продуцированию органических кислот. Одним из наиболее изученных является Yarrowia lipolytica, а также ряд других неферментирующих дрожжей, таких как Candida sp., Pichia sp. и Kluyveromyces sp. Эти микроорганизмы имеют высокую ферментативную активность и способны эффективно конвертировать простые и сложные субстраты в целевые продукты — органические кислоты. Механизм биосинтеза органических кислот у дрожжей обусловлен переработкой углеродных источников, таких как глюкоза, ксилоза или углеводороды, в метаболиты цикла Кребса и других анаболических путей. Особенность дрожжей Y. lipolytica заключается в их способности перерабатывать гидрофобные субстраты (например, жирные кислоты и масла), что делает их крайне перспективными для переработки отходов растительного и животного происхождения [116]. Например, эти дрожжи могут продуцировать лимонную и дикарбоновые кислоты путем разложения алканов.
Помимо лимонной кислоты, дрожжи проявляют высокую эффективность в продуцировании янтарной кислоты. Этот метаболит рассматривается как «платформенная химия», применяемая во многих областях — от биоматериалов до фармацевтики. Штаммы дрожжей Candida utilis и частично модифицированные S. cerevisiae были задействованы для масштабного производства янтарной кислоты, а использование генетических методов для улучшения штаммов позволило повысить выход этой кислоты в промышленных процессах [117].
Ещё одним важным направлением является биосинтез молочной кислоты. Дрожжи Kluyveromyces lactis, продуцируют молочную кислоту при благоприятных условиях анаэробной ферментации [118]. Этот процесс применяется для производства биоразлагаемых пластиков.
4.4. Микроводоросли — продуценты органических кислотМикроводоросли представляют собой перспективные организмы для синтеза органических кислот в промышленных масштабах благодаря своей способности к быстрой ферментации и высокой эффективности усвоения углекислого газа [119]. Они могут производить разнообразные органические кислоты, такие как миристиновая, пальмитиновая и ланолевая, а также другие метаболиты, включая липиды и углеводы [120]. Основные преимущества их использования заключаются в способности к высокоэффективному поглощению CO2, что способствует снижению уровня парниковых газов [121], а также в скорости роста, позволяющей получать большие объемы продукции за короткий период [122]. Микроводоросли способны выживать как в пресной, так и в соленой воде [123]. На данный момент существуют сложности наработки биопродуктов с помощью микроводорослей в промышленных масштабах, которые связаны с оптимизацией условий культивирования и извлечения метаболитов [124].
Несмотря на очевидные достижения, производство органических кислот сталкивается с рядом ограничений. Например, использование дорогостоящих чистых субстратов, низкий выход продукта в некоторых случаях и сложность масштабирования процессов требуют разработки более эффективных методов синтеза. Продолжающиеся исследования в этой области направлены на снижение себестоимости производства, повышение продуктивности и расширение области применения органических кислот.
5. Получение липидовЛипиды являются важными компонентами клеточных мембран, обеспечивая структурную целостность клеток и транспорт веществ [125.]. В промышленности они широко применяются для производства биодизеля, пищевых добавок, а также в кремах, лосьонах и фармацевтике [126]. В последние годы микробные липиды стали перспективной альтернативой традиционным, благодаря быстрому производству, экологичности и возможности выращивания на различных субстратах, включая отходы сельского хозяйства.
Особое внимание уделяется применению микробных липидов в пищевой индустрии, например, в производстве омега-3 и других жирных кислот [127]. Полиненасыщенные жирные кислоты, такие как n-3 (ω-3) и n-6 (ω-6), полезны для здоровья и интенсивно используются в обогащенных продуктах [128]. Также с помощью микроорганизмов получают высокоценное какао-масло, стоимость которого увеличивается из-за растущего спроса [129].
Современные технологии, включая редактирование генов методом CRISPR/Cas9, позволили значительно повысить эффективность производства микробных липидов и усовершенствовать ферментационные процессы [130].
5.1. Бактериальные и дрожжевые липидыПроизводство бактериальной биомассы для производства липидов становится перспективным направлением благодаря возможности её использования в качестве биотоплива. Многие представители бактерий, такие как Rhodococcus opacus, Acinetobacter calcoaceticus и Acinetobacter spp., накапливают до 87% своей массы в виде триацилглицеридов, которые конвертируются в биодизель [131-132]. По сравнению с масличными растительными культурами, бактерии растут быстрее, дают более высокий выход липидов и эффективно используют различные углеродные субстраты, включая промышленные отходы [133].
Накопление триацилглицеридов связано с клеточным стрессом и состоит из двух стадий: активного роста в богатой углеродом среде и "масляной" фазы, которая запускается при недостатке азота [134]. Выбор субстрата (глюкозы, сахарозы или дешевых отходов) влияет на эффективность процесса. Например, бактерия вида R. opacus аккумулировала до 64,47% липидов, используя гидролизат жома сахарного тростника как дешевый субстрат [135].
Современные методы, такие как дополнительное добавление необходимых питательных веществ, улучшили выход липидов, продлевая фазу роста продуцентов [136]. Так, добавление глицерина в культуральную среду усилило накопление липидов у представителя вида R. opacus [137]. Таким образом, методы оптимизации субстратов и условий культивирования являются ключом к повышению рентабельности микробного производства липидов.
Основные рода дрожжей, используемые для производства липидов, включают Yarrowia, Candida, Rhodotorula, Rhodosporidium, Cryptococcus, Trichosporon и Lipomyces, но только около 30 видов способны накапливать более 20% своей биомассы в виде липидов [138-139]. Наиболее изученными являются представители видов Yarrowia lipolytica, Rhodotorula glutinis, Rhodosporidium toruloides, Cryptococcus curvatus и Lipomyces starkeyi, интересен также Trichosporon fermentans [140]. Липидопродукция стимулируется избытком углерода из глюкозы, глицерина или жирных кислот при ограничении азота, что приводит к синтезу триацилглицеридов (ТАГ) — главных липидных запасов, составляющих до 90% общего содержания липидов [141-142].
Высокое соотношение углерода к азоту (C/N) и активность ферментов, таких как глицерол-3-фосфатацилтрансфераза, усиливают липогенез [143-144]. Насыщенность кислородом стимулирует синтез ненасыщенных жирных кислот, а кислород также важен для цикла Кребса [145]. Факторы среды, такие как температура, pH, а также фосфор для мембранных фосфолипидов, существенно влияют на процесс [146-147].
5.2. Грибные липидыЛипиды, накопленные грибами, включают триглицериды, жирные кислоты и полярные липиды, служащие энергетическим запасом и компонентами клеточных мембран. Грибы A. niger могут производить биомассу с содержанием белка до 52% и липидов от 1% до 10% [148-149], а Mucor circinelloides и A. terreus, обладают высокой липидопродуктивностью, накапливая до 38% сухой биомассы в виде липидов. Например, A. terreus богат олеиновой и стеариновой кислотами, что делает его перспективным для использования вкачестве сырья при производстве биодизеля [150-151].
Накопление липидов происходит в две стадии: активный рост биомассы и переход к липогенезу, когда источники азота истощаются, но углерод остается в избытке [152-153]. Основой процесса становится метаболизм углеводов и синтез ацетил-КоА, конвертируемого в липиды [154].
Ферментация грибов может осуществляться двумя методами: глубинное и твердотельное культивирование. Глубинная ферментация позволяет лучше контролировать параметры окружающей среды и снижает риск загрязнений, что делает её предпочтительной для индустриального производства [155-156]. Она широко используется для получения грибных липидов и биомассы, особенно благодаря своей эффективности и степени освоения технологии.
5.3. Липиды микроводорослейСостав биомассы микроводорослей сильно варьируется в зависимости от видов и условий роста. Содержание белка колеблется от 18 до 56%, липидов — от 7 до 48%, углеводов — от 15 до 46% [157]. Например, Spirulina maxima может содержать до 71% белка, а микроводоросли содержат незаменимые аминокислоты, полиненасыщенные жирные кислоты, каротиноиды и хлорофилл [158-159]. C. vulgaris и Scenedesmus spp. отличаются высоким содержанием белка (56,1% и 49%) и липидов (12,5% и 12,1%) [160]. Они демонстрируют разнообразные профили жирных кислот: C. vulgaris богата полиненасыщенными жирными кислотами, а S. platensis — насыщенными, включая пальмитиновую кислоту.
Грибы и дрожжи превосходят микроводоросли и бактерии по производству липидов благодаря способности метаболизировать широкий спектр субстратов, что способствует выходу жирных кислот, таких как пальмитиновая (C16:0), олеиновая (C18:1), линолевая (C18:2) и α-линолевая кислоты (C18:3) [161-162]. Эти соединения востребованы в пищевой, косметической и фармацевтической промышленности благодаря их свойствам и питательной ценности. Линолевая и γ-линолевая кислоты используются в питании и при лечении воспалений, а насыщенные жирные кислоты, такие как миристиновая (C14:0), находят применение в средствах личной гигиены [163]. Производство липидов грибами и дрожжами демонстрирует коммерческий потенциал благодаря высокому выходу липидов и широким возможностям их применения, включая биотопливо.
5.4. Экстракция липидовЛипиды, продуцируемые микроорганизмами, включают жирные кислоты с длиной цепи от 6 до 36 атомов углерода и классифицируются как насыщенные, мононенасыщенные или полиненасыщенные [164-165]. Эти жирные кислоты широко используются в биотопливе, а мононенасыщенные или полиненасыщенные, производимые микроводорослями и траустохитридами, находят применение в нутрицевтиках [164].
Извлечение липидов остаётся ключевой задачей для промышленного производства из-за их разнообразной полярности и расположения (внутриклеточно и внеклеточно). Внеклеточные липиды извлекаются проще, используя фильтрацию или центрифугирование, тогда как внутриклеточные требуют разрушения клеточной стенки [166]. Это осуществляется методами влажной или сухой биомассы. Метод влажной экстракции растворителем предпочтительнее из-за низких энергозатрат, однако он зависит от доступности липидов и процесса массопереноса [131, 166].
Химические методы экстракции растворителями обеспечивают высокую эффективность, но создают экологические и финансовые риски [167]. Механические методы, такие как бисерное измельчение и гомогенизация, более безопасны, но требуют значительных энергозатрат [168]. Физические методы, включая технологию импульсного электрического поля и ультразвуковую обработку, являются экологичными и масштабируемыми, демонстрируя высокий выход липидов и низкое потребление энергии [169-170].
В целом, следует отметить, что микробные липиды являются перспективным источником для производства устойчивых биопродуктов, таких как биосурфактанты, каротиноиды, диетические добавки, биотопливо, фармацевтические и косметические продукты [171-172], что подчеркивает их многоцелевой промышленный потенциал [173-174]. Их универсальность охватывает энергетику, питание, косметику и биоразлагаемые материалы. Производство липидов на основе агропромышленных отходов увеличивает эффективность синтеза, снижает использование земель и конкуренцию с продовольственными культурами, делая их устойчивым сырьем для биотоплива и укрепляя их значение в биоэкономике [171, 175].
6. Антибиотики как продукт промышленной биотехнологииАнтибиотики — это гетерогенная группа биологически активных молекул, подавляющих жизнеспособность микроорганизмов. Изначально к ним относили только соединения природного происхождения, продуцируемые микроорганизмами, но позже — и синтетические препараты [176-177]. Первый противоинфекционный препарат, сальварсан, был синтезирован Паулем Эрлихом в 1907 году и использовался для лечения сифилиса [178-179]. Открытие пенициллина Александром Флемингом в 1928 году положило начало эпохе антибиотиков, но его промышленное производство началось лишь в 40-х годах благодаря Penicillium chrysogenum [180-181].
Золотым веком антибиотиков считаются 40–60-е годы XX века, когда было открыто множество природных и синтетических соединений [182-183]. Классическими продуцентами являются грибы и бактерии, в частности актинобактерии, синтезирующие около 90% коммерческих препаратов [184]. В последние годы исследуются микроводоросли и цианобактерии, обладающие потенциалом для разработки новых антимикробных препаратов [185-186]. Современные разработки сосредоточены на химической модификации известных микробных метаболитов, что позволяет создавать полусинтетические антибиотики с улучшенными характеристиками, включая широкий спектр действия и устойчивость [176]. Современные исследования показывают высокий потенциал энтомопатогенных грибов [187] и микроводорослей [188] как источников новых антибиотиков.
6.1. Классификация антибиотиковСуществует несколько вариантов классификации антибиотиков: по типу фармакологических эффектов (бактерицидные и бактериостатические), по спектру активности (широкого и узкого спектра действия), однако более распостранена классификация на основе их молекулярной структуры и способа действия [189-190]. По способу действия антибиотики разделяют на ингибирующие синтез клеточной стенки, нарушающие структуру или функцию клеточной мембраны и синтез белка, воздействущие на структуру и функции нуклеиновых кислот и блокирующие ключевые метаболические пути [191]. На основе молекулярной (химической) структуры антибиотики классифицируют на: β-лактамные, макролиды, тетрациклины, хинолоны, аминогликозиды, сульфониламиды, пептидные антибиотики, оксазолидины [192]. Следует отметить, что β-лактамы, аминогликозиды, гликопептиды, хинолоны и липопептиды обладают бактерицидным действием, а сульфаниламиды, тетрациклины и оксазолидиноны – бактериостатическим [193-194]. Среди макролидов встречаются препараты как бактерицидного, так бактериостатического характера. Поскольку одним из способов получения новых антибиотиков является модификация химической структуры уже известных, то некоторые классы антибиотиков, отличающиеся по химической структуре и включающие природные и полусинтетические соединения, будут рассмотрены подробнее ниже.
6.1.1. β-лактамные антибиотикиАнтибиотики класса β-лактамов содержат в своей химической структуре β-лактамное кольцо, которое ингибирует синтез пептидогликана, связываясь с пенициллинсвязывающими белками бактерий. Это нарушает клеточную стенку, вызывая лизис и гибель клеток [195-196]. К β-лактамам относятся пенициллины, цефалоспорины, монобактамы и карбапенемы, различающиеся по боковым цепям и структуре [197].
Пенициллины содержат β-лактамное кольцо, соединенное с тиазолидиновым кольцом. Они ферментативно синтезируются на основе 6-аминопенициллановой кислоты [198], синтез которой зависит от питательной среды и генетической модификации штаммов [199]. Производство полусинтетических пенициллинов включает химическое добавление боковых цепей к 6-аминопенициллановой кислоте для получения соединений, таких как ампициллин и амоксициллин [200-201].
Цефалоспорины, вырабатываемые A. chrysogenum, отличаются устойчивостью и спектром активности. Производство полусинтетических цефалоспоринов основано на модификации 7-аминоцефалоспорановой кислоты [202]. Генетическая инженерия используется для повышения титров и разработки новых соединений [203-204].
Монобактамы, такие как азтреонам, имеют моноциклическую структуру и полностью синтетическое происхождение [205].
Карбапенемы, например тиенамицин, впервые выделили в 1976 году из Streptomyces cattleya [206-207]. Однако из-за низкого выхода и нестабильности их коммерческое производство базируется на химическом синтезе.
6.1.2. МакролидыМакролиды – это антибиотики, содержащие 14-, 15-, 16- или 18-членные лактоновые кольца с присоединенными аминосахарами [208-209]. Первый макролид, эритромицин А, был выделен из Saccharopolyspora erythreus (ранее Streptomyces erythreus) в 1952 году. Он стал прототипом для создания полусинтетических аналогов, таких как азитромицин и кларитромицин [210-211].
14-членный олеандомицин синтезируется Streptomyces antibioticus, а 18-членный фидаксомицин – Dactylosporangium aurantiacum [212-213]. Состав питательной среды сильно влияет на биосинтез макролидов: например, для эритромицина в среду добавляют пропиловый спирт, а для нистатина (продуцентом является S. noursei) — аммонийный азот вместо нитратного [214].
6.1.3. ТетрациклиныТетрациклины – антибиотики широкого спектра действия, основанные на тетрациклическом ядре (A, B, C, D) [215]. Первый тетрациклин, хлортетрациклин (ауреомицин), был выделен в 1945 году из представителя рода Streptomyces Бенджамином Дуггаром, а в 1949 году Александром Финлеем был обнаружен окситетрациклин (террамицин) [216]. Их изучение позволило создать синтетические и полусинтетические аналоги, а также модифицировать среду культивирования для получения соединений с измененной структурой, например, тетрациклина вместо хлортетрациклина при отсутствии хлора [217]. Полусинтетический доксициклин получают из окситетрациклина, например, путем дегидратации при атоме углерода С6 с использованием катализатора (родий на углероде) [218].
Тетрациклины делятся на поколения: природные (1-е), полусинтетические (2-е) и синтетические (3-е) [219-220]. Их получение долгое время основывалось на использовании штаммов рода Streptomyces или полусинтетическом процессе, позднее одобрены клинические препараты третьего поколения [221].
6.1.4. АминогликозидыАминогликозиды содержат два или более аминосахаров, соединенных гликозидными связями с аминоциклическим кольцом, и являются одними из старейших антибиотиков наряду с β-лактамами, макролидами и тетрациклинами [222-223]. Первым из соединений этого класса был открыт стрептомицин в 1943 году, полученный из Streptomyces griseus; вторым был обнаружен канамицин в культуральной жидкости Streptomyces kanamyceticus [224]. Высокая токсичность стрептомицина обусловила необходимость поиска новых менее токсичных представителей аминогликозидов, что послужило открытию таких антибиотиков, как гентамицин (выделен в процессе ферментации из Micromonospora purpurea), неомицин (выделен из Streptomyces fradiae), тобрамицин (выделен из Streptomyces tenebrarius) и амикацин (полусинтетическое производное канамицина) и др. [225].
6.1.5. Пептидные антибиотикиАнтимикробные пептиды – это природные соединения с широким спектром действия против бактерий, вирусов, грибов и даже раковых клеток. Они синтезируются некоторыми организмами как средство защиты или конкурентной борьбы [226-228]. Первый пептидный антибиотик, грамицидин, был открыт в 1939 году Рене Дюбо из бактерий рода Bacillus [229]. Классификация антимикробных пептидов варьируется и включает классы, такие как полипептидные, липопептидные и гликопептидные антибиотики.
Полипептиды, например полимиксины, представляют собой катионные циклические декапептиды, синтезируемые Bacillus polymyxa. В клинической практике используются полимиксины B и E (колистин) [230-231].
Липопептиды, такие как даптомицин, образуются Streptomyces roseosporus и используются для лечения инфекций благодаря их антимикробной активности [232-233].
Гликопептиды, как ванкомицин и тейкопланин, содержат пептидный каркас с ароматическими аминокислотами и сахарами. Продуцентами являются Amycolatopsis orientalis и Actinoplanes teichomyceticus. Современные полусинтетические аналоги, такие как телаванцин и оритаванцин, имеют улучшенные свойства, включая более эффективное связывание с мишенью и удлиненный период полураспада [234-235].
Можно сделать следующее обобщение: развитие промышленного производства антибиотиков происходило как в направлении улучшения производительности штаммов-продуцентов, так и в направлении разработки состава питательных сред и различных методов каталитического воздействия на молекулу антибиотика для удаления нежелательных боковых цепей и/или присоединения новых [236-237].
6.2. Основные этапы биотехнологического производства антибиотиковПромышленное производство антибиотиков включает множество этапов, направленных на повышение выхода продукта и снижение себестоимости, с использованием современных технологий, таких как компьютерное управление параметрами ферментации [238-241]. Например, технология получения пенициллина значительно эволюционировала: вместо периодического процесса с использованием лактозы стало применяться полунепрерывное культивирование на субстратах, таких как смеси глюкозы и сахарозы, с компьютерным контролем параметров [200].
Промышленное производство включает следующие основные этапы: получение штаммов-продуцентов, разработка условий культивирования, выделение и очистка антибиотика, масштабирование и производственная ферментация [242]. Генетическая и метаболическая инженерия позволяет создавать высокоэффективные штаммы-продуценты [243-245]. Условия культивирования включают подбор среды с источниками углерода, азота и фосфора, а также факторов, таких как микроэлементы и аминокислоты, что может усиливать биосинтез [198, 242]. Например, для A. chrysogenum добавление метионина стимулирует синтез цефалоспоринов [200].
Антибиотики, являясь вторичными метаболитами, синтезируются в фазе стресса микроорганизма после завершения экспоненциальной фазы роста, что используется при двухступенчатом культивировании: сначала наращивается биомасса, а затем запускается активный синтез антибиотика на специальной среде [246-247]. Полученные препараты могут подвергаться химическим модификациям для производства полусинтетических антибиотиков.
После ферментации осуществляется обработка культуральной жидкости, выделение и очистка продукта. Методы включают экстракцию органическими растворителями, адсорбцию, ионный обмен и химическое осаждение, выбор подхода зависит от характеристик антибиотика [239, 242]. Например, пенициллины G и V извлекаются органическими растворителями, тогда как аминогликозиды требуют других методов из-за их полярности [240]. На завершающем этапе препарат обрабатывают для удаления воды, часто с использованием лиофильной сушки для сохранения биологической активности [248-249].
Таким образом, современные технологии ферментации и последующей обработки, сопровождаемые инструментами генетической инженерии и процессной оптимизацией, позволяют успешно производить антибиотики в промышленных масштабах.
7. Витамины, получаемые посредством микробного синтезаВ последние десятилетия наблюдается значительный интерес к экологически чистым и устойчивым методам производства витаминов. Витамины, необходимые для поддержания здоровья человека, традиционно получались из растительных источников или синтетическим путем. Однако использование микроорганизмов, таких как бактерии, грибы и микроводоросли, открывает новые горизонты для биотехнологического производства витаминов в промышленных масштабах [250-251].
7.1. Бактерии как источники витаминовБактерии являются ключевыми участниками процессов биосинтеза витаминов, например виды родов Corynebacterium и Bacillus, используются для производства витаминов группы B – B12, B2 и B6. Например, компания BASF (Германия) занимается производством рибофлавина с использованием генетически модифицированого штамма B. subtilis [252]. C. glutamicum широко применяется в промышленности для биосинтеза витамина B12 благодаря своей способности усваивать различные источники углерода и азота [253]. Представители Propionibacterium shermanii, Propionibacterium freudenreichii и Pseudomonas denitrificans демонстрируют высокую продуктивность при оптимизации условий ферментации (рН, температура) и состава питательной среды, поэтому используются для промышленного синтеза цианокобаламина (витамина B12) [254]. Одним из еще наиболее значимых примеров является производство аскорбиновой кислоты (витамина C), основанное на комбинированной технологии Рейхштайна-Грюсснера, включающей последовательные стадии химического синтеза и биотехнологической конверсии. В процессе участвуют бактерии Gluconobacter oxydans, осуществляющие трансформацию глюкозы в сорбитол и последующее его окисление до сорбозы [255]. Бактерии Brevibacterium spp. способны эффективно усваивать углеводы и производить пантотеновую кислоту (витамин B5), который учавствует в синтезе коэнзима A [256]. Фотосинтезирующие бактерии, такие как Rhodobacter sphaeroides и Corynebacterium, играют важную роль в биосинтезе витамина A из его предшественника, β-каротина [257].
7.2. Роль грибов в производстве витаминовГрибы также активно используются в биотехнологической индустрии благодаря их способности продуцировать витамины, особенно эргостерол — предшественник витамина D2. Например, дрожжи S. cerevisiae обладают способностью накапливать большое количество эргостерола, который под воздействием ультрафиолетового излучения превращается в витамин D2 [258]. A. oryzae и A. niger нашли применение в производстве витамина В2 благодаря их высокой ферментационной активности и простоте адаптации к промышленным условиям [259]. Eremothecium ashbyi также является одним из микроорганизмов, используемых для производства витамина B2 (рибофлавина) [260]. Грибы C. maltosa используется в промышленном производстве эргостерина и убихинонов путем экстракции из микробных липидов, которые являются побочным продуктом при производстве белково-витаминного концентрата [261].
Различные плесневые грибы способны синтезировать витамин А (в форме β-каротина), при этом содержание провитамина у них во много раз превышает его количество в растительных источниках. Например, при культивировании гриба Blakeslea trispora в биомассе накаплвается 3-8 тыс. мкг β-каротина на 1 г мицелия, тогда как в моркови всего 60 мкг. B. trispora является одним из наиболее эффективных продуцентов каротиноидов, демонстрируя стабильную продуктивность при контролируемых условиях ферментации продолжительностью 6-7 суток [262]. Для промышленного получения β-каротина используется специальный процесс ферментации, где женские и мужские штаммы мицелия выращивают раздельно, а затем смешивают в биореакторе в соотношении 1:15, что позволяет достичь концентрации β-каротина до 2000 мг/л [263].
7.3. Продукция витаминов микроводорослямиМикроводоросли представляют собой одну из наиболее перспективных платформ для промышленного производства витаминов [264]. Особое внимание уделяется микроводорослям, способным продуцировать каротиноиды, включая β-каротин. Микроводоросли, такие как Chlorella и Spirulina, способным синтезировать витамины A, E и D [265]. Эти водоросли могут быть использованы как в качестве пищи, так и в качестве источника витаминов для пищевых добавок. Кроме того, они содержат множество других питательных веществ, таких как белки, минералы и антиоксиданты [266]. Особенно важным является то, что содержание некоторых витаминов в микроводорослях значительно превышает их концентрацию в наземных растениях [267].
Получаемые из микроводорослей витамины и каротиноиды находят широкое применение в пищевой промышленности (обогащение продуктов питания), фармацевтике (производство витаминных добавок) и косметологии (создание косметических средств). Однако, несмотря на значительные перспективы, развитие промышленной биотехнологии микроводорослей ограничено высокими производственными затратами [263]. Решение этой проблемы требует оптимизации всех этапов производства - от селекции штаммов до методов экстракции и очистки.
Таким образом, микробиологический синтез витаминов демонстрирует высокую эффективность и экологическую безопасность, что делает его приоритетным направлением в современной витаминной промышленности.
8. Гормоны, получаемые посредством микробного синтезаГормоны и стероиды играют важную роль в медицине, сельском хозяйстве и биотехнологии [268]. Современные методы получения этих биомолекул включают не только химический синтез, но и биосинтез с использованием бактерий, грибов и водорослей [269]. Эти методы обеспечивают возможность получения сложных молекул с высокой эффективностью, меньшими затратами и меньшим воздействием на окружающую среду по сравнению с традиционными подходами [270]. В последние годы микроорганизмы рассматриваются как перспективные биокаталитические платформы, которые могут производить как природные, так и модифицированные аналоги стероидных соединений и гормонов.
8.1. Синтез гормонов и стероидов с использованием бактерийСинтез гормонов с помощью бактерий может быть экономически выгоден и позволяет производить гормоны без необходимости извлечения их из органических источников. Бактерии E. coli и B. subtilis являются модельными организмами для гетерологической экспрессии различных пептидных гормонов [271]. Значительным достижением биотехнологии стала разработка метода получения инсулина с использованием рекомбинантных ДНК-технологий [272]. Данный метод основан на внедрении генов, кодирующих продукцию препроинсулина, в геном бактериальных клеток, что обеспечивает их способностью к масштабной продукции этого гормона [273]. Бактерии также могут синтезировать и другие гормоны, например, соматотропин, который используется для стимуляции роста сельскохозяйственных животных [274].
Одним из важных направлений исследований является изучение использования актиномицетов и других бактерий для биотрансформации сложных стероидных соединений. Исследования показали, что штаммы бактерий Rhodococcus ruber, Mycobacterium sp. и другие, обладают ключевыми ферментами, которые могут избирательно изменять структуру стероидов в заданных позициях. Например, был описан процесс гидроксилирования стероидов по позиции C-9 и C-11, являющийся важным этапом в производстве лекарственных препаратов, таких как кортизон и преднизолон [275]. Донова М.В. с соавторами при изучении катаболизма стероидов бактериями рода Mycobacterium, способными разрушать стероидную молекулу с удалением боковой цепи, продемонстрировали процесс, важный для получения таких промежуточных продуктов, как андростенон и андростадиендион [276].
8.2. Биотехнологический синтез гормонов грибамиГрибы родов Aspergillus, Penicillium и Rhizopus, являются ключевыми биотехнологическими агентами в процессе биотрансформации стероидов [277]. Их уникальная способность к специфическому гидроксилированию стероидных соединений позволяет получать важные фармацевтические препараты, включая кортизон и преднизолон [278]. Например, Rhizopus nigricans традиционно используется для гидроксилирования прогестерона, что позволяет получать фармацевтические препараты с противовоспалительными и иммуносупрессивными свойствами. Механизм гидроксилирования прогестерона грибом Rh. nigricans, включает преобразование прогестерона в менее токсичный 11α-гидроксипрогестерон, который затем выводится из мицелия. Процесс гидроксилирования является индуцируемым и включает специфические рецепторы прогестерона [279].
В современной биотехнологии особое место занимает продукция грибами стеринов [280], среди которых эргостерин выступает важным предшественником для синтеза витамина D [281]. Уникальные ферментативные системы грибов обеспечивают высокоселективное модифицирование стероидных молекул [282], что существенно упрощает получение необходимых соединений. Благодаря углублённому пониманию метаболических путей грибов [283] и прогрессу в области генетической инженерии [284], стало возможным создание специализированных штаммов с улучшенными производственными характеристиками. Эти “суперштаммы” демонстрируют способность к масштабному синтезу сложных гормональных соединений [285], что открывает новые перспективы для промышленного применения.
Несмотря на перспективы синтеза гормонов грибами, масштабирование процесса сопряжено с определёнными трудностями. Ключевыми ограничениями выступают относительно низкая скорость роста грибных культур и недостаточная концентрация целевых метаболитов, что требует оптимизации условий ферментации [286].
8.3. Водоросли как источник гормонов и стероидовВодоросли представляют собой уникальный природный источник стероидных соединений и фитогормонов, обладающих потенциальной биологической активностью [287]. Особенно выделяются представители Sargassum и Chlorella, которые характеризуются наличием специфических стероидных компонентов, что делает их перспективным сырьем для производства биологически активных добавок [288]. Фитогормональный комплекс водорослей включает важные регуляторы роста растений: ауксины, цитокинины и гиббереллины. Эти соединения не только участвуют в регуляции роста и развития самих водорослей, но и оказывают стимулирующее воздействие на высшие растения при использовании в качестве биостимуляторов [289]. Таким образом, биотехнологические процессы, основанные на использовании водорослей, могут быть приложены для получения новых источников сельскохозяйственных фитогормонов, а также пищевых и кормовых добавок.
Заключение
Продукты промышленной биотехнологии играют важную роль в различных областях человеческой деятельности. Несмотря на активное использование растений и животных в медицинской, косметической, сельскохозяйственной и пищевой промышленности, именно микробиологическое направление является ключевым звеном промышленных биотехнологий. Это связано с получением антибиотиков, ферментов, биопрепаратов на основе микробной биомассы, аминокислот, кормовых белков, биоэтанола, биогазов, витаминов, органических кислот, полисахаридов, а также биопродуктов, полученных на основе технологии рекомбинантных ДНК (гормоны, биологически активные вещества и т.д.)). Промышленная биотехнология активно развивается, что способствует выявлению новых микроорганизмов-продуцентов, совершенствованию технологических процессов и созданию инновационных продуктов. При этом остаются актуальными задачи по повышению резистентности микроорганизмов, оптимизации процессов ферментации и снижению себестоимости производства. Промышленная микробная биотехнология обладает значительным потенциалом для стимулирования экономического роста, улучшения состояния здоровья населения и охраны окружающей среды. Продолжение научных исследований в этой области имеет принципиальное значение.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
- Mordor Intelligence. Biotech market - Growth, trends, COVID-19 impact, and forecasts (2021 - 2026). URL: https://www.mordorintelligence.com
- Nielsen J., Tillegreen C. B., Petranovic D. Innovation trends in industrial biotechnology. Trends Biotechnol., 40 (10), 1160–1172 (2022). DOI: 10.1016/j.tibtech.2022.03.007
- РБК. Биотехнологии в России: рынок, тренды и прогнозы. 2021. URL: РБК.
- Александрова Е. В., Польшакова Н. В. Развитие биотехнологий как фактор экономической безопасности России. Вестник техносферной безопасности и сельского развития, №1 (30), 2022. URL: https://cyberleninka.ru/article/n/razvitie-biotehnologiy-kak-faktor-ekonomicheskoy-bezopasnosti-rossii
- Lian J., HamediRad M., Zhao H. Advancing Metabolic Engineering of Saccharomyces cerevisiae Using the CRISPR/Cas System. J., 13 (9), e1700601 (2018). DOI: 10.1002/biot.201700601
- Zabed H., Sahu J. N., Suely A., Boyce A. N., Faruq G. Bioethanol production from renewable sources: Current perspectives and technological progress. Sustain. Energy Rev., 71, 475–501 (2017). DOI: 10.1016/j.rser.2016.12.076
- Khan, M. I., Shin, J. H., Kim, J. D. The promising future of microalgae: current status, challenges, and optimization of a sustainable and renewable industry for biofuels, feed, and other products. Microbial Cell Factories, 17(1), 36 (2018). DOI: 10.1186/s12934-018-0879-x
- López N. I., Pettinari M. J., Nikel P. I., Méndez B. S. Polyhydroxyalkanoates: Much More than Biodegradable Plastics. Appl. Microbiol., 93, 73–106 (2015). DOI: 10.1016/bs.aambs.2015.06.001
- Шарипова А. Р. Методы выделения и очистки биотехнологической продукции. Science Time, №9 (33), 2016. URL: https://cyberleninka.ru/article/n/metody-vydeleniya-i-ochistki-biotehnologicheskoy-produktsii
- Chen G.-Q., Patel M. K. Plastics derived from biological sources: present and future: a technical and environmental review. Rev., 112 (4), 2082–2099 (2012). DOI: 10.1021/cr200162d
- Możejko-Ciesielska J., Kiewisz R. Bacterial polyhydroxyalkanoates: Still fabulous? Res., 192, 271–282 (2016). DOI: 10.1016/j.micres.2016.07.010
- Hammami K., Souissi Y., Cherif A., Neifar M. Challenges for polyhydroxyalkanoates production: extremophilic bacteria, waste streams, and optimization strategies. MedCrave Online J. Appl. Bionics Biomech., 7 (1), 101–107 (2023). DOI: 10.15406/mojabb.2023.07.00181
- Freitas F., Alves V. D., Reis M. A. Advances in bacterial exopolysaccharides: from production to biotechnological applications. Trends Biotechnol., 29 (8), 388–398 (2011). DOI: 10.1016/j.tibtech.2011.03.008
- Kang H. K., Nguyen T. T. H., Jeong H. N., et al. Molecular cloning and characterization of a novel glucansucrase from Leuconostoc mesenteroides subsp. mesenteroides LM34. Bioprocess Eng., 19, 605–612 (2014). DOI: 10.1007/s12257-014-0116-3
- Rehm B. H. Bacterial polymers: biosynthesis, modifications and applications. Rev. Microbiol., 8 (8), 578–592 (2010). DOI: 10.1038/nrmicro2354
- Mangolim C. S., Silva T. T. d., Fenelon V. C., Koga L. N., Ferreira S. B. d. S., Bruschi M. L., et al. Description of recovery method used for curdlan produced by Agrobacterium sp. IFO 13140 and its relation to the morphology and physicochemical and technological properties of the polysaccharide. PLoS ONE, 12 (2), e0171469 (2017). DOI: 10.1371/journal.pone.0171469.
- Rinaudo M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci., 31 (7), 603–632 (2006). DOI: 10.1016/j.progpolymsci.2006.06.001
- Novak M., Vetvicka V. Beta-glucans, history, and the present: immunomodulatory aspects and mechanisms of action. Immunotoxicol., 5 (1), 47–57 (2008). DOI: 10.1080/15476910802019045
- Spring P., Wenk C., Dawson K. A., Newman K. E. The effects of dietary mannaoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella-challenged broiler chicks. Sci., 79 (2), 205–211 (2000). DOI: 10.1093/ps/79.2.205
- Singh R. S., Saini G. K., Kennedy J. F. Pullulan: Microbial sources, production and applications. Polym., 73 (4), 515–531 (2008). DOI: 10.1016/j.carbpol.2008.01.003
- Farina J. I., Sineriz F., Molina O. E., Perotti N. I. High scleroglucan production by Sclerotium rolfsii: Influence of medium composition. Lett., 23 (9), 717–720 (2001). DOI: 10.1023/A:1005351123156
- Giavasis I. Bioactive fungal polysaccharides as potential functional ingredients in food and nutraceuticals. Opin. Biotechnol., 26, 162–173 (2014). DOI: 10.1016/j.copbio.2014.01.010
- Selvasekaran P., Mahalakshmi, Roshini F., Angalene L. A., Chandini, Sunil T., Chidambaram R. Fungal Exopolysaccharides: production and biotechnological industrial applications in food and allied sectors. In: Yadav A. N. (ed.) Recent Trends in Mycological Research. Springer International Publishing, pp. 311–357 (2021).
- Draget K. I., Smidsrød O., Skjåk-Bræk G. Alginates from algae. Biopolymers Online (2005). DOI: 10.1002/3527600035.BPOL6008
- Necas J., Bartosikova L. Carrageenan: a review. Med., 58 (4), 187–205 (2013).
- Keasling J. D. Manufacturing molecules through metabolic engineering. Science, 330 (6009), 1355–1358 (2010). DOI: 10.1126/science.1193990
- Jackson C. J., Gillam E. M. J., Ollis D. L. Directed evolution of enzymes. In: Lew M., Hung-Wen L. (eds.) Comprehensive Natural Products II, pp. 723–749. Oxford: Elsevier (2010). DOI: 10.1016/B978-0-08-102690-8.00675-8
- Gupta R., Gupta N., Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties. Microbiol. Biotechnol., 64 (6), 763–781 (2004). DOI: 10.1007/s00253-004-1568-8
- Schallmey M., Singh A., Ward O. P. Developments in the use of Bacillus species for industrial production. J. Microbiol., 50 (1), 1–17 (2004). DOI: 10.1139/w03-076
- Bala A., Singh B. Development of an environmental-benign process for efficient pretreatment and saccharification of Saccharum biomasses for bioethanol production. Energy, 130, 12–24 (2019). DOI: 10.1016/j.renene.2018.06.033
- Singhania R. R., Sukumaran R. K., Patel A. K., Larroche C., Pandey A. Advancement and comparative profiles in the production technologies using solid-state and submerged fermentation for microbial cellulases. Enzyme Microb. Technol., 46 (7), 541–549 (2010). DOI: 10.1016/j.enzmictec.2010.03.010
- Pandey A., Selvakumar P., Soccol C. R., Nigam P. S. Solid state fermentation for the production of industrial enzymes. Sci., 77, 149–162 (1999).
- Jørgensen H., et al. Production of cellulases and hemicellulases by three Penicillium species: Effect of substrate and evaluation of cellulase adsorption by capillary electrophoresis. Enzyme Microb. Technol., 36 (1), 42–48 (2005). DOI: 10.1016/j.enzmictec.2004.03.023
- Chojnacka K., Noworyta A. Evaluation of Spirulina sp. growth in photoautotrophic, heterotrophic and mixotrophic cultures. Enzyme Microb. Technol., 34 (5), 461–465 (2004). DOI: 10.1016/j.enzmictec.2003.12.002
- Markou G., Nerantzis E. Microalgae for high-value compounds and biofuels production: a review with focus on cultivation under stress conditions. Adv., 31 (8), 1532–1542 (2013). DOI: 10.1016/j.biotechadv.2013.07.011
- Kirk O., Borchert T. V., Fuglsang C. C. Industrial enzyme applications. Opin. Biotechnol., 13 (4), 345–351 (2002). DOI: 10.1016/S0958-1669(02)00328-2
- Schäfer T., Borchert T. W., Nielsen V. S., et al. Industrial enzymes. Adv. Biochem. Eng. Biotechnol., 105, 59–131 (2007). DOI: 10.1007/10_2006_039
- Толкачева А.А., Черенков Д.А., Корнеева О.С., Пономарев П.Г. Ферменты промышленного назначения – обзор рынка ферментных препаратов и перспективы его развития. Вестник Воронежского государственного университета инженерных технологий, 79 (4 (74)), 197-203. (2017).
- Лукин А.А., Данилов М.Б., Пирожинский С.Г. Особенности применения микробиальных ферментов в отраслях производственной сферы. Международный научно-исследовательский журнал. 8 (98), 94-98 (2020) DOI: 10.23670/IRJ.2020.98.8.013
- Maurer K.-H. Detergent proteases. Curr. Opin. Biotechnol., 15, 330–334 (2004). DOI: 10.1016/j.copbio.2004.06.005
- Estell D. A., Graycar T. P., Wells J. A. Engineering an enzyme by site-directed mutagenesis to be resistant to chemical oxidation. Biol. Chem., 260 (11), 6518–6521 (1985).
- Bryan P. N. Protein engineering of subtilisin. Biochim. Biophys. Acta, 1543 (2), 203–222 (2000). DOI: 10.1016/S0167-4838(00)00235-1
- Sumantha A., Larroche C., Pandey A. Microbiology and industrial biotechnology of food-grade proteases: A perspective. Food Technol. Biotechnol., 44, 211–220 (2006).
- Koka R., Weimer B. C. Investigation of the ability of a purified protease from Pseudomonas fluorescens r098 to hydrolyze bitter peptides from cheese. Dairy J., 10, 75–79 (2000). DOI: 10.1016/S0958-6946(00)00023-6
- Cheng S. W., Hu H. M., Shen S. W., Takagi H., Asano M., Tsai, Y. C. Production and characterization of keratinase of a feather-degrading Bacillus licheniformis PWD-1. Biotechnol. Biochem., 59 (12), 2239–2243 (1995). DOI: 10.1271/bbb.59.2239
- Arunachalam C., Saritha K. Protease enzyme: An eco-friendly alternative for leather industry. Indian J. Sci. Technol., 12, 29–32 (2009). DOI: 10.17485/ijst/2009/v2i12/29553
- Rai S. K., Roy J. K., Mukherjee A. K. Characterisation of a detergent-stable alkaline protease from a novel thermophilic strain Paenibacillus tezpurensis sp. nov. AS-S24-II. Microbiol. Biotechnol., 85 (5), 1437–1450 (2010). DOI: 10.1007/s00253-009-2145-y
- Doukyu N., Ogino H. Organic solvent-tolerant enzymes. Biochem. Eng. J., 48, 270–282 (2010). DOI: 10.1016/j.bej.2009.09.009
- Brockman H. L. Lipases. Encycl. Chem., 729–732 (2013). DOI: 10.1016/B978-0-12-378630-2.00118-3
- Reis P., Holmberg K., Watzke H., Leser M. E., Miller R. Lipases at interfaces: a review. Colloid Interface Sci., 147-148, 237–250 (2009). DOI: 10.1016/j.cis.2008.06.001
- Gotor-Fernández V., Vicente G. Use of Lipases in Organic Synthesis. In: Polaina, J., MacCabe, A.P. (eds) Industrial Enzymes. Springer, Dordrecht. (2007). DOI: 10.1007/1-4020-5377-0_18
- Hasan F., Shah A. A., Hameed A. Industrial applications of microbial lipases. Enzyme Microb. Technol., 39 (2), 235–251 (2006). DOI: 10.1016/j.enzmictec.2005.10.016
- Reetz M. T. Lipases as practical biocatalysts. Curr. Opin. Chem. Biol., 6 (2), 145–150 (2002). DOI: 10.1016/S1367-5931(02)00297-1
- Bajaj A., Lohan P., Jha P. N., Mehrotra R. Biodiesel production through lipase catalyzed transesterification: An overview. Mol. Catal. B Enzym., 62 (1), 9–14 (2010). DOI: 10.1016/j.molcatb.2009.09.018
- Tan T., Lu J., Nie K., Deng L., Wang F. Biodiesel production with immobilized lipase: A review. Adv., 28 (5), 628–634 (2010). DOI: 10.1016/j.biotechadv.2010.05.012
- Bijttebier A., Goesaert H., Delcour J. A. Amylase action pattern on starch polymers. Biologia, 63, 989–999 (2008). DOI: 10.2478/s11756-008-0169-x
- van der Maarel M. J., van der Veen B., Uitdehaag J. C., Leemhuis H., Dijkhuizen L. Properties and applications of starch-converting enzymes of the alpha-amylase family. Biotechnol., 94 (2), 137–155 (2002). DOI: 10.1016/S0168-1656(01)00407-2
- de Souza P. M., de Oliveira Magalhães P. Application of microbial α-amylase in industry - A review. J. Microbiol., 41 (4), 850–861 (2010). DOI: 10.1590/S1517-83822010000400004
- Nielsen J. E., Borchert T. V. Protein engineering of bacterial alpha-amylases. Biophys. Acta, 1543 (2), 253–274 (2000). DOI: 10.1016/S0167-4838(00)00240-5
- Singh R. S., Saini G. K., Kennedy J. F. Maltotriose syrup preparation from pullulan using pullulanase. Polym., 80, 401–407 (2010). DOI: 10.1016/j.carbpol.2009.11.040
- Jayani R. S., Saxena S., Gupta R. Microbial pectinolytic enzymes: A review. Process Biochem., 40 (9), 2931–2944 (2005). DOI: 10.1016/j.procbio.2005.03.026
- Jacob N. Pectinolytic Enzymes. In: Singh nee’ Nigam P., Pandey A. (eds) Biotechnology for Agro-Industrial Residues Utilisation. Springer, Dordrecht (2009). DOI: 10.1007/978-1-4020-9942-7_21
- Kashyap D. R., Vohra P. K., Chopra S., Tewari R. Applications of pectinases in the commercial sector: a review. Technol., 77 (3), 215–227 (2001). DOI: 10.1016/S0960-8524(00)00118-8
- Hoondal G. S., Tiwari R. P., Tewari R., Dahiya N., Beg Q. K. Microbial alkaline pectinases and their industrial applications: a review. Microbiol. Biotechnol., 59 (4-5), 409–418 (2002). DOI: 10.1007/s00253-002-1061-1
- Beg Q. K., Kapoor M., Mahajan L., Hoondal G. S. Microbial xylanases and their industrial applications: a review. Microbiol. Biotechnol., 56 (3-4), 326–338 (2001). DOI: 10.1007/s002530100704
- Subramaniyan S., Prema P. Biotechnology of microbial xylanases: enzymology, molecular biology, and application. Rev. Biotechnol., 22 (1), 33–64 (2002). DOI: 10.1080/07388550290789450
- Butt M. S., Tahir-Nadeem M., Ahmad Z., Sultan M. T. Xylanases and their applications in baking industry. Food Technol. Biotechnol., 46 (1), 22–31 (2008).
- Matsumura S., Sakiyama K., Toshima K. Preparation of octyl β-D-xylobioside and xyloside by xylanase-catalyzed direct transglycosylation reaction of xylan and octanol. Lett., 21 (1), 17–22 (1999). DOI: 10.1023/A:1005464025881
- Rodríguez Couto S., Toca Herrera J. L. Industrial and biotechnological applications of laccases: a review. Adv., 24 (5), 500–513 (2006). DOI: 10.1016/j.biotechadv.2006.04.003
- Yokoyama K., Nio N., Kikuchi Y. Properties and applications of microbial transglutaminase. Microbiol. Biotechnol., 64 (4), 447–454 (2004). DOI: 10.1007/s00253-003-1539-5
- Zhu Y., Rinzema A., Tramper J., Bol J. Microbial transglutaminase—a review of its production and application in food processing. Microbiol. Biotechnol., 44, 277–282 (1995). DOI: 10.1007/BF00169916
- Gembeh S.V., Jr H.M.F., Taylor M. M., Brown E.M., Marmer W.N. Application of transglutaminase to derivatize proteins: 1. Studies on soluble proteins and preliminary results on wool. J. Sci. Agric. 85, 418–424, (2005) DOI: 10.1002/jsfa.1999
- Lei X. G., Porres J. M., Mullaney E. J., Brinch-Pedersen H. Phytase: Source, Structure and Application. In: Polaina J., MacCabe A. P. (eds) Industrial Enzymes. Springer, Dordrecht (2007). DOI: 10.1007/1-4020-5377-0_29
- Ravindran V., Bryden W. L., Kornegay E. T. Phytates: Occurrence, bioavailability and implications in poultry nutrition. Avian Biol. Rev., 6, 125–143 (1995).
- Maenz D. D. Enzymatic characteristics of phytases as they relate to their use in animal feed. In: Bedford M. R., Partridge G. G. (eds.) Enzymes in Farm Animal Nutrition, pp. 61–84. Wallington: CABI (2001). DOI: 10.1079/9780851993935.0061
- Hull P. Glucose Syrups: Technology and Applications. Wiley-Blackwell (2010). DOI: 10.1002/9781444314748
- White J. S. Sucrose, HFCS, and Fructose: History, Manufacture, Composition, Applications, and Production. In: Rippe J. (eds) Fructose, High Fructose Corn Syrup, Sucrose and Health. Nutrition and Health. Humana Press, New York, NY (2014). DOI: 10.1007/978-1-4899-8077-9_2
- Singh P., Ban Y. G., Kashyap L., Siraree A., Singh J. Sugar and Sugar Substitutes: Recent Developments and Future Prospects. In: Sugar and Sugar Derivatives: Changing Consumer Preferences. Springer, Singapore (2020). DOI: 10.1007/978-981-15-6663-9_4
- Zargaraan A., Kamaliroosta L., Yaghoubi A. S., Mirmoghtadaie L. Effect of substitution of sugar by high fructose corn syrup on the physicochemical properties of bakery and dairy products: A review. Food Sci. Res., 3 (4), 3–11 (2016). DOI: 10.18869/acadpub.nfsr.3.4.3
- Песчанская, В. А., Андриевская, Д. В., Ульянова, Е. В. Перспективы использования глюкозно-фруктозных сиропов при производстве спиртных напитков. Пиво и напитки, 3, 13–16, (2020). DOI: 10.24411/2072–9650–2020–10033
- Sano C. History of glutamate production. Am. J. Clin. Nutr., 90 (3), 728S–732S (2009). DOI: 10.3945/ajcn.2009.27462F
- Cesari M., Rossi G. P., Sticchi D., Pessina A. C. Is homocysteine important as risk factor for coronary heart disease? Metab. Cardiovasc. Dis., 15 (2), 140–147 (2005). DOI: 10.1016/j.numecd.2004.04.002
- Wu G. Amino acids: metabolism, functions, and nutrition. Amino Acids, 37 (1), 1–17 (2009). DOI: 10.1007/s00726-009-0269-0
- Paul B. D., Sbodio J. I., Xu R., et al. Cystathionine γ-lyase deficiency mediates neurodegeneration in Huntington's disease. Nature, 509 (7498), 96–100 (2014). DOI: 10.1038/nature13136
- Wu G., Bazer F. W., Cudd T. A., Meininger C. J., Spencer T. E. Maternal nutrition and fetal development. Nutr., 134 (9), 2169–2172 (2004). DOI: 10.1093/jn/134.9.2169
- Ikeda M. Amino acid production processes. Adv. Biochem. Eng. Biotechnol., 79, 1–35 (2003). DOI: 10.1007/3-540-45989-8_1
- Kurihara K. Glutamate: from discovery as a food flavor to role as a basic taste (umami). J. Clin. Nutr., 90 (3), 719S–722S (2009). DOI: 10.3945/ajcn.2009.27462D
- Renneberg R. High grade cysteine no longer has to be extraxted from hair. In Demain, AL, eds. Biotechnology for beginners. Academic Press: Amsterdam, pp.106 (2008)
- Sereewatthanawut I., Prapintip S., Watchiraruji K., et al. Extraction of protein and amino acids from deoiled rice bran by subcritical water hydrolysis. Technol., 99 (3), 555–561 (2008). DOI: 10.1016/j.biortech.2006.12.030
- Klejdus B., Lojková L., Kula E., et al. Supercritical fluid extraction of amino acids from birch (Betula pendula Roth) leaves and their liquid chromatographic determination with fluorimetric detection. Sep. Sci., 31 (8), 1363–1373 (2008). DOI: 10.1002/jssc.200700560
- Pourali O., Asghari F. S., Yoshida H. Sub-critical water treatment of rice bran to produce valuable materials. Food Chem., 115 (1), 1–7 (2009). DOI: 10.1016/j.foodchem.2008.11.099
- Zuend S. J., Coughlin M. P., Lalonde M. P., Jacobsen E. N. Scaleable catalytic asymmetric Strecker syntheses of unnatural alpha-amino acids. Nature, 461 (7266), 968–970 (2009). DOI: 10.1038/nature08484
- Gröger H. Catalytic enantioselective Strecker reactions and analogous syntheses. Rev., 103 (8), 2795–2828 (2003). DOI: 10.1021/cr020038p
- Singh S., Gogoi B. K., Bezbaruah R. L. Racemic resolution of some DL-amino acids using Aspergillus fumigatus L-amino acid oxidase. Microbiol., 63 (1), 94–99 (2011). DOI: 10.1007/s00284-011-9955-8
- Hsiao H. Y., Walter J. F., Anderson D. M., Hamilton B. K. Enzymatic production of amino acids. Genet. Eng. Rev., 6, 179–219 (1988). DOI: 10.1080/02648725.1988.10647848
- Sugimoto M. Amino Acids, Production Processes. In: Encyclopedia of Industrial Biotechnology (2010). DOI: 10.1002/9780470054581.eib025
- Becker J., Zelder O., Häfner S., et al. From zero to hero—design-based systems metabolic engineering of Corynebacterium glutamicum for L-lysine production. Eng., 13 (2), 159–168 (2011). DOI: 10.1016/j.ymben.2011.01.003
- Aoki R., Wada M., Takesue N., Tanaka K., Yokota A. Enhanced glutamic acid production by a H+-ATPase-defective mutant of Corynebacterium glutamicum. Biotechnol. Biochem., 69 (8), 1466–1472 (2005). DOI: 10.1271/bbb.69.1466
- Hermann T. Industrial production of amino acids by coryneform bacteria. Biotechnol., 104 (1-3), 155–172 (2003). DOI: 10.1016/S0168-1656(03)00149-4
- Zahoor A., Lindner S. N., Wendisch V. F. Metabolic engineering of Corynebacterium glutamicum aimed at alternative carbon sources and new products. Struct. Biotechnol. J., 3, e201210004 (2012). DOI: 10.5936/csbj.201210004
- Khan N. S., Mishra I. M., Singh R. P., Prasad B. Modeling the growth of Corynebacterium glutamicum under product inhibition in L-glutamic acid fermentation. Eng. J., 25, 173–178 (2005). DOI: 10.1016/j.bej.2005.01.025
- Park J. H., Lee S. Y. Fermentative production of branched chain amino acids: a focus on metabolic engineering. Microbiol. Biotechnol., 85 (3), 491–506 (2010). DOI: 10.1007/s00253-009-2307-y
- Sauer M., Porro D., Mattanovich D., Branduardi P. Microbial production of organic acids: expanding the markets. Trends Biotechnol., 26 (2), 100–108 (2008). DOI: 10.1016/j.tibtech.2007.11.006
- Upadhyaya B. P., DeVeaux L. C., Christopher, L. P. Metabolic engineering as a tool for enhanced lactic acid production. Trends Biotechnol., 32(12), 637–644. (2014) DOI: 10.1016/j.tibtech.2014.10.005
- Wang B., Rutherfurd-Markwick K., Zhang X. X., Mutukumira A. N. Kombucha: Production and Microbiological Research. Foods, 11(21), 3456 (2022). DOI: 10.3390/foods11213456
- Cheng K. K., Zhao X. B., Zeng J., et al. Downstream processing of biotechnological produced succinic acid. Microbiol. Biotechnol., 95 (4), 841–850 (2012). DOI: 10.1007/s00253-012-4214-x
- Wang C., Li Q., Tang H., et al. Membrane fouling mechanism in ultrafiltration of succinic acid fermentation broth. Technol., 116, 366–371 (2012). DOI: 10.1016/j.biortech.2012.03.099
- Soccol C. R., Vandenberghe L. P., Rodrigues C., Pandey A. New perspectives for citric acid production and application. Food Technol. Biotechnol., 44, 141–149 (2006).
- Angumeenal A. R., Venkappayya D. An overview of citric acid production. LWT - Food Sci. Technol., 50 (2), 367–370 (2013). DOI: 10.1016/j.lwt.2012.05.016
- Dhillon G. S., Brar S. K., Kaur S., Verma M. Screening of agro-industrial wastes for citric acid bioproduction by Aspergillus niger NRRL 2001 through solid state fermentation. Sci. Food Agric., 93 (7), 1560–1567 (2013). DOI: 10.1002/jsfa.5920
- Singh O. V., Sharma A., Singh R. P. Optimisation of fermentation conditions for gluconic acid production by a mutant of Aspergillus niger. Indian J. Exp. Biol., 39 (11), 1136–1143 (2001).
- Willke T., Vorlop K. D. Biotechnological production of itaconic acid. Microbiol. Biotechnol., 56 (3-4), 289–295 (2001). DOI: 10.1007/s002530100685 114.
- Peace C. G., O’Neill L. A. The role of itaconate in host defense and inflammation. Clin. Invest., 132 (2), e148548 (2022). DOI: 10.1172/JCI148548
- Zhao M., Lu X., Zong H., Li J., Zhuge B. Itaconic acid production in microorganisms. Biotech let, 40(3), 455–464 (2018). DOI: 10.1007/s10529-017-2500-5
- Ilica R. A., Kloetzer L., Galaction A. I., Caşcaval D. Fumaric acid: production and separation. Biotechnol Lett, 41(1), 47–57, (2019). DOI: 10.1007/s10529-018-2628-y
- Max B., Salgado J. M., Rodríguez N., Cortés S., Converti A., Domínguez J. M. Biotechnological production of citric acid. J. Microb., 41(4), 862–875 (2010). DOI:10.1590/s1517-83822010000400005
- Slininger P.J., Liu S.C., Dien B.S. Yeast strains for organic acid production. US Patent 7.838.262, 2010.
- Porro D., Branduardi P. Production of Organic Acids by Yeasts and Filamentous Fungi. In: Sibirny A. (eds) Biotechnology of Yeasts and Filamentous Fungi. Springer, Cham (2017). DOI: 10.1007/978-3-319-58829-2_7
- Chisti Y. Biodiesel from microalgae. Biotechnol. Adv., 25 (3), 294–306 (2007). DOI: 10.1016/j.biotechadv.2007.02.001
- Hu Q., Sommerfeld M., Jarvis E., et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances. Plant J., 54 (4), 621–639 (2008). DOI: 10.1111/j.1365-313X.2008.03492.x
- Wang B., Li Y., Wu N., Lan C. Q. CO₂ bio-mitigation using microalgae. Microbiol. Biotechnol., 79 (5), 707–718 (2008). DOI: 10.1007/s00253-008-1518-y
- Griffiths M. J., Harrison S. T. L. Lipid productivity as a key characteristic for choosing algal species for biodiesel production. Appl. Phycol., 21 (5), 493–507 (2009). DOI: 10.1007/s10811-008-9392-7
- Borowitzka M. A. High-value products from microalgae—their development and commercialisation. Appl. Phycol., 25, 743–756 (2013). DOI: 10.1007/s10811-013-9983-9
- Mata T. M., Martins A. A., Caetano N. S. Microalgae for biodiesel production and other applications: A review. Sustain. Energy Rev., 14 (1), 217–232 (2010). DOI: 10.1016/j.rser.2009.07.020
- Lenaz G. The role of lipids in the structure and function of membranes. Biochem., 6, 233–343 (1979). DOI: 10.1007/978-1-4615-7945-8_5
- Li-Beisson Y., Nakamura Y., Harwood J. Lipids: From Chemical Structures, Biosynthesis, and Analyses to Industrial Applications. Biochem., 86, 1–18 (2016). DOI: 10.1007/978-3-319-25979-6_1
- Ochsenreither K., Glück C., Stressler T., Fischer L., Syldatk C. Production Strategies and Applications of Microbial Single Cell Oils. Microbiol., 7, 1539 (2016). DOI: 10.3389/fmicb.2016.01539
- Shah A. M., Yang W., Mohamed H., Zhang Y., Song Y. Microbes: A Hidden Treasure of Polyunsaturated Fatty Acids. Nutr., 9, 827837 (2022). DOI: 10.3389/fnut.2022.827837
- Ghazani S. M., Marangoni A. G. Microbial Lipids for Foods. Trends Food Sci. Technol., 119, 593–607 (2022). DOI: 10.1016/j.tifs.2021.10.014
- Lakhawat S. S., Malik N., Kumar V., Kumar S., Sharma P. K. Implications of CRISPR-Cas9 in Developing Next Generation Biofuel: A Mini-review. Protein Pept. Sci., 23 (9), 574–584 (2022). DOI: 10.2174/1389203723666220907110310
- Dong T., Knoshaug E. P., Pienkos P. T., Laurens L. M. L. Lipid Recovery from Wet Oleaginous Microbial Biomass for Biofuel Production: A Critical Review. Energy, 177, 879–895 (2016). DOI: 10.1016/j.apenergy.2016.06.002
- Patel A., Karageorgou D., Rova E., et al. An Overview of Potential Oleaginous Microorganisms and Their Role in Biodiesel and Omega-3 Fatty Acid-Based Industries. Microorganisms, 8 (3), 434 (2020). DOI: 10.3390/microorganisms8030434
- Koreti D., Kosre A., Jadhav S. K., Chandrawanshi N. K. A comprehensive review on oleaginous bacteria: an alternative source for biodiesel production. Bioprocess., 9 (1), 47 (2022). DOI: 10.1186/s40643-022-00527-1
- Dourou M., Aggeli D., Papanikolaou S., Aggelis G. Critical steps in carbon metabolism affecting lipid accumulation and their regulation in oleaginous microorganisms. Microbiol. Biotechnol., 102 (6), 2509–2523 (2018). DOI: 10.1007/s00253-018-8813-z
- Mahmood Z., Singh A. K. Rhodococcus opacus high-cell-density batch cultivation with a bagasse hydrolysate for possible triacylglycerol synthesis. Bioprocess., 7, 209–217 (2023). DOI: 10.4103/bbrj.bbrj_55_23
- Behera B., Unpaprom Y., Ramaraj R., et al. Integrated biomolecular and bioprocess engineering strategies for enhancing the lipid yield from microalgae. Sustain. Energy Rev., 148, 111270 (2021). DOI: 10.1016/j.rser.2021.111270
- Thanapimmetha A., Suwaleerat T., Saisriyoot M., Chisti Y., Srinophakun P. Production of carotenoids and lipids by Rhodococcus opacus PD630 in batch and fed-batch culture. Bioprocess Biosyst. Eng., 40 (1), 133–143 (2017). DOI: 10.1007/s00449-016-1681-y
- Ageitos J. M., Vallejo J. A., Veiga-Crespo P., Villa T. G. Oily yeasts as oleaginous cell factories. Microbiol. Biotechnol., 90 (4), 1219–1227 (2011). DOI: 10.1007/s00253-011-3200-z
- Sargeant L. A., Chuck C. J., Donnelly J., Bannister C. D., Scott R. J. Optimizing the lipid profile, to produce either a palm oil or biodiesel substitute, by manipulation of the culture conditions for Rhodotorula glutinis. Biofuels, 5 (1), 33–43 (2014). DOI: 10.4155/bfs.13.64
- Zhu L. Y., Zong M. H., Wu H. Efficient lipid production with Trichosporon fermentans and its use for biodiesel preparation. Technol., 99 (16), 7881–7885 (2008). DOI: 10.1016/j.biortech.2008.02.033
- Chopra J., Sen R. Process optimization involving critical evaluation of oxygen transfer, oxygen uptake and nitrogen limitation for enhanced biomass and lipid production by oleaginous yeast for biofuel application. Bioprocess Biosyst. Eng., 41 (8), 1103–1113 (2018). DOI: 10.1007/s00449-018-1939-7
- Abeln F., Chuck C. J. The history, state of the art and future prospects for oleaginous yeast research. Cell Fact., 20 (1), 221 (2021). DOI: 10.1186/s12934-021-01712-1
- Lopes H. J. S., Bonturi N., Kerkhoven E. J., Miranda E. A., Lahtvee P. J. C/N ratio and carbon source-dependent lipid production profiling in Rhodotorula toruloides. Microbiol. Biotechnol., 104 (6), 2639–2649 (2020). DOI: 10.1007/s00253-020-10386-5
- Zhang H., Wang Z., Sun C., et al. A phospholipid:diacylglycerol acyltransferase is involved in the regulation of phospholipids homeostasis in oleaginous Aurantiochytrium sp. Biofuels Bioprod., 16 (1), 142 (2023). DOI: 10.1186/s13068-023-02396-y
- Beopoulos A., Nicaud J. M., Gaillardin C. An overview of lipid metabolism in yeasts and its impact on biotechnological processes. Microbiol. Biotechnol., 90 (4), 1193–1206 (2011). DOI: 10.1007/s00253-011-3212-8
- Hu M., Qiu L., Wang Y. The PHO Pathway Involved in Phosphate Metabolism in Yeast for Efficient Phosphorus Removal. E3S Web Conf., 53, 04023 (2018). DOI: 10.1051/e3sconf/20185304023
- De Oliva-Neto P., Dorta C., Flavia A., Carvalho A., Gomes De Lima V. M. The Brazilian Technology of Fuel Ethanol Fermentation-Yeast Inhibition Factors and New Perspectives to Improve the Technology. Process. Energy Commun. Curr. Res. Technol. Dev., 1, 371–379 (2013).
- Kam S., Kenari A. A., Younesi H. Production of Single Cell Protein in Stickwater by Lactobacillus acidophilus and Aspergillus niger. Aquat. Food Prod. Technol., 21, 403–417 (2012). DOI: 10.1080/10498850.2011.605539
- Isaza-Pérez F., Ramírez-Carmona M., Rendón-Castrillón L., Ocampo-López C. Potential of residual fungal biomass: a review. Sci. Pollut. Res., 27 (12), 13019–13031 (2020). DOI: 10.1007/s11356-020-08193-6
- Shah A. M., Mohamed H., Fazili A. B. A., Yang W., Song Y. Investigating the Effect of Alcohol Dehydrogenase Gene Knockout on Lipid Accumulation in Mucor circinelloides WJ11. J. Fungi, 8 (9), 917 (2022). DOI: 10.3390/jof8090917
- Youssef, G.A.; Elrefaey, A.M.; El-Aassar, S. Potential Assessment of Oleaginous Fungi for Sustainable Biodiesel Production: Screening, Identification and Lipid Production Optimization. Preprints, (2020). DOI: 10.21203/rs.3.rs-127210/v1
- Zhang X. Y., Li B., Huang B. C., et al. Production, Biosynthesis, and Commercial Applications of Fatty Acids From Oleaginous Fungi. Nutr., 9, 873657 (2022). DOI: 10.3389/fnut.2022.873657
- Dzurendova S., Zimmermann B., Tafintseva V., et al. Metal and Phosphate Ions Show Remarkable Influence on the Biomass Production and Lipid Accumulation in Oleaginous Mucor circinelloides. Fungi, 6 (4), 260 (2020). DOI: 10.3390/jof6040260
- van Aarle I. M., Olsson P. A. Fungal lipid accumulation and development of mycelial structures by two arbuscular mycorrhizal fungi. Environ. Microbiol., 69 (11), 6762–6767 (2003). DOI: 10.1128/AEM.69.11.6762-6767.2003
- Athenaki M., Gardeli C., Diamantopoulou P., et al. Lipids from yeasts and fungi: physiology, production and analytical considerations. Appl. Microbiol., 124 (2), 336–367 (2018). DOI: 10.1111/jam.13633
- Ali H., Zulkali M. D. Design Aspects of Bioreactors for Solid-State Fermentation: A Review. Biochem. Eng., 25, 255–266 (2011).
- Finkel Z. V., Follows M. J., Liefer J. D., et al. Phylogenetic Diversity in the Macromolecular Composition of Microalgae. PLoS One, 11 (5), e0155977 (2016). DOI: 10.1371/journal.pone.0155977
- Tibbetts S. M., Milley J. E., Lall S. P. Chemical Composition and Nutritional Properties of Freshwater and Marine Microalgal Biomass Cultured in Photobioreactors. Appl. Phycol., 27, 1109–1119 (2015). DOI: 10.1007/s10811-014-0428-x
- de Oliveira M. A. C. L., Monteiro M. P. C., Robbs P. G., Leite S. G. F. Growth and Chemical Composition of Spirulina Maxima and Spirulina Platensis Biomass at Different Temperatures. Int., 7, 261–275 (1999). DOI: 10.1023/A:1009233230706
- El-fayoumy E. A., Ali H. E. A., Elsaid K., Elkhatat A., Al-Meer S., Zul Helmi Rozaini M., Azmuddin Abdullah M. Co-production of high-density biomass and high-value compounds via two-stage cultivation of Chlorella vulgaris using light intensity and a combination of salt stressors. Biomass Convers. Biorefin., 14, 22673–22686 (2023). DOI: 10.1007/s13399-023-04442-z
- Xue S. J., Chi Z., Zhang Y., Li Y. F., Liu G. L., Jiang H., Hu Z., Chi Z. M. Fatty acids from oleaginous yeasts and yeast-like fungi and their potential applications. Rev. Biotechnol., 38 (7), 1049–1060 (2018). DOI: 10.1080/07388551.2018.1428167
- Fan Y. Y., Chapkin R. S. Importance of dietary gamma-linolenic acid in human health and nutrition. Nutr., 128 (9), 1411–1414 (1998). DOI: 10.1093/jn/128.9.1411
- Venkatakrishnan P., Palanisamy P. Synthesis and Characterization of Myristic Acid---Infused Al₂O₃/CuO/MWCNT Nanocomposites for Energy Storage and Cooling Applications. Scr., 99 (2024).
- Patel A., Karageorgou D., Rova E., Katapodis P., Rova U., Christakopoulos P., Matsakas L. An Overview of Potential Oleaginous Microorganisms and Their Role in Biodiesel and Omega-3 Fatty Acid-Based Industries. Microorganisms, 8 (3), 434 (2020). DOI: 10.3390/microorganisms8030434
- Fahy E., Subramaniam S., Brown H. A., Glass C. K., Merrill A. H., Jr Murphy R. C., Raetz C. R., Russell D. W., Seyama Y., Shaw W., Shimizu T., Spener F., van Meer G., VanNieuwenhze M. S., White S. H., Witztum J. L., Dennis E. A. A comprehensive classification system for lipids. Lipid Res., 46 (5), 839–861 (2005). DOI: 10.1194/jlr.E400004-JLR200
- Yellapu S. K., Bharti, Kaur R., et al. Recent developments of downstream processing for microbial lipids and conversion to biodiesel. Technol., 256, 515–528 (2018). DOI: 10.1016/j.biortech.2018.01.129
- Joseph Antony Sundarsingh T., Ameen F., Ranjitha J., Raghavan S., Shankar V. Engineering Microbes for Sustainable Biofuel Production and Extraction of Lipids. Research and Future Perspectives. Fuel, 355, 129532 (2024). DOI: 10.1016/j.fuel.2023.129532
- Silva J. M. E., Martins L. H. D. S., Moreira D. K. T., Silva L. D. P., Barbosa P. P. M., Komesu A., Ferreira N. R., Oliveira J. A. R. Microbial Lipid Based Biorefinery Concepts: A Review of Status and Prospects. Foods, 12 (10), 2074 (2023). DOI: 10.3390/foods12102074
- Deng Y., Wang W., Zhao S., Yang X., Xu W., Guo M., Xu E., Ding T., Ye X., Liu D. Ultrasound-Assisted Extraction of Lipids as Food Components: Mechanism, Solvent, Feedstock, Quality Evaluation and Coupled Technologies-A Review. Trends Food Sci. Technol., 122, 83-96, (2022) DOI: 10.1016/j.tifs.2022.01.034
- Karimi Sani I., Mehrnoosh F., Rasul N. H., Hassani B., Mohammadi H., Gholizadeh H., Sattari N., Kaveh M., Khodaei S. M., Alizadeh Sani M., Eghbaljoo H., Assadpour E., Zhang F., Jafari S. M. Pulsed electric field-assisted extraction of natural colorants; principles and applications. Food Biosci., 61, 104746 (2024). DOI: 10.1016/j.fbio.2024.104746.
- Carruthers D. N., Lee T. S. Translating advances in microbial bioproduction to sustainable biotechnology. Bioeng. Biotechnol., 10, 968437 (2022). DOI: 10.3389/fbioe.2022.968437
- Long X., He N., He Y., Jiang J., Wu T. Biosurfactant surfactin with pH-regulated emulsification activity for efficient oil separation when used as emulsifier. Technol., 241, 200–206 (2017). DOI: 10.1016/j.biortech.2017.05.120
- Béligon V., Christophe G., Fontanille P., Larroche C. Microbial Lipids as Potential Source to Food Supplements. Opin. Food Sci., 7, 35–42 (2016). DOI: 10.1016/j.cofs.2015.10.002
- Ummalyma S. B., Sirohi R., Udayan A., et al. Sustainable microalgal biomass production in food industry wastewater for low-cost biorefinery products: a review. Rev., 1–23 (2022). DOI: 10.1007/s11101-022-09814-3
- Tomás-Pejó E., Morales-Palomo S., González-Fernández C. Microbial lipids from organic wastes: Outlook and challenges. Technol., 323, 124612 (2021). DOI: 10.1016/j.biortech.2020.124612
- Russell A. D. Types of antibiotics and synthetic antimicrobial agents. In: Denyer S. P., Hodges N. A., German S. P. (eds.) Hugo and Russell’s Pharmaceutical Microbiology. 7th Ed. Blackwell Science, UK, pp. 152–186 (2004). DOI: 10.1002/9780470988329.ch10
- Etebu E., Arikekpar I. Antibiotics: Classification and mechanisms of action with emphasis on molecular perspectives. J. Appl. Microbiol. Biotechnol. Res., 4, 90–101 (2016).
- Gelpi A., Gilbertson A., Tucker J. D. Magic bullet: Paul Ehrlich, Salvarsan and the birth of venereology. Transm. Infect., 91 (1), 68–69 (2015). DOI: 10.1136/sextrans-2014-051779
- Mohr K. I. History of Antibiotics Research. Curr. Top. Microbiol. Immunol., 398, 237–272 (2016). DOI: 10.1007/82_2016_499
- Hare R. New light on the history of penicillin. Hist., 26 (1), 1–24 (1982). DOI: 10.1017/S0025727300040758
- Raper K. B., Alexander D. F., Coghill R. D. Penicillin: II. Natural Variation and Penicillin Production in Penicillium notatum and Allied Species. Bacteriol., 48 (6), 639–659 (1944). DOI: 10.1128/jb.48.6.639-659.1944
- Zaffiri L., Gardner J., Toledo-Pereyra L. H. History of antibiotics. From salvarsan to cephalosporins. J. Investig. Surg., 25 (2), 67–77 (2012). DOI: 10.3109/08941939.2012.664099
- Hutchings M. I., Truman A. W., Wilkinson B. Antibiotics: past, present and future. Opin. Microbiol., 51, 72–80 (2019). DOI: 10.1016/j.mib.2019.10.008
- Jose P. A., Jha B. New Dimensions of Research on Actinomycetes: Quest for Next Generation Antibiotics. Microbiol., 7, 1295 (2016). DOI: 10.3389/fmicb.2016.01295
- Ayswaria R., Vijayan J., Nathan V. K. Antimicrobial peptides derived from microalgae for combating antibiotic resistance: Current status and prospects. Cell Biochem. Funct., 41 (2), 142–151 (2023). DOI: 10.1002/cbf.3779
- Cepas V., Gutiérrez-Del-Río I., López Y., Redondo-Blanco S., Gabasa Y., Iglesias M.J., Soengas R., Fernández-Lorenzo A., López-Ibáñez S., Villar C.J., Martins C.B., Ferreira J.D., Assunção M.F.G., Santos L.M.A., Morais J., Castelo-Branco R., Reis M.A., Vasconcelos V., López-Ortiz F., Lombó F., Soto S.M. Microalgae and Cyanobacteria Strains as Producers of Lipids with Antibacterial and Antibiofilm Activity. Mar. Drugs, 19 (12), 675 (2021). DOI: 10.3390/md19120675
- Wang W., Wang T.-T. Editorial: Fungal secondary metabolites as valuable chemical entities for medicines and agrochemicals. Microbiol., 14, 1150023 (2023). DOI: 10.3389/fmicb.2023.1150023.
- Bhowmick S., Mazumdar A., Moulick A., Adam V. Algal metabolites: An inevitable substitute for antibiotics. Adv., 43, 107571 (2020). DOI: 10.1016/j.biotechadv.2020.107571.
- Calderon C. B., Sabundayo B. P. Antimicrobial classifications: Drugs for bugs. In: Schwalbe R., Steele-Moore L., Goodwin A. C. (eds.) Antimicrobial Susceptibility Testing Protocols. CRC Press, Taylor and Francis Group (2007). DOI: 10.1201/9781420014495.ch2
- Pancu D. F., Scurtu A., Macasoi I. G., Marti D., Mioc M., Soica C., Coricovac D., Horhat D., Poenaru M., Dehelean C. Antibiotics: Conventional Therapy and Natural Compounds with Antibacterial Activity—A Pharmaco-Toxicological Screening. Antibiotics, 10 (4), 401 (2021). DOI: 10.3390/antibiotics10040401
- Wright G. D. Q&A: Antibiotic resistance: where does it come from and what can we do about it? BMC Biol., 8, 123 (2010). DOI: 10.1186/1741-7007-8-123
- Etebu E., Arikekpar I. Antibiotics: Classification and mechanisms of action with emphasis on molecular perspectives. J. Appl. Microbiol. Biotechnol. Res., 4, 90–101 (2016).
- Ullah H., Ali S. Classification of Anti-Bacterial Agents and Their Functions. Agents (2017).
- Loree J., Lappin S. L. Bacteriostatic Antibiotics. StatPearls Publishing: Treasure Island, FL, USA (2020). DOI: 10.5772/intechopen.68695
- Cho H., Uehara T., Bernhardt T. G. Beta-lactam antibiotics induce a lethal malfunctioning of the bacterial cell wall synthesis machinery. Cell, 159 (6), 1300–1311 (2014). DOI: 10.1016/j.cell.2014.11.017
- Heesemann J. Resistenzmechanismen gegen Betalaktamantibiotika [Mechanisms of resistance to beta-lactam antibiotics]. Infection, 21 (Suppl 1), S4–S9 (1993). DOI: 10.1007/BF01710336
- James C. W., Gurk-Turner C. Cross-reactivity of beta-lactam antibiotics. (Baylor Univ. Med. Cent.), 14 (1), 106–107 (2001). DOI: 10.1080/08998280.2001.11927741
- Aharonowitz Y., Cohen G., Martin J. F. Penicillin and cephalosporin biosynthetic genes: structure, organization, regulation, and evolution. Rev. Microbiol., 46, 461–495 (1992). DOI: 10.1146/annurev.mi.46.100192.002333.
- van den Berg M. A., Albang R., Albermann K., et al. Genome sequencing and analysis of the filamentous fungus Penicillium chrysogenum. Biotechnol., 26 (10), 1161–1168 (2008). DOI: 10.1038/nbt.1498
- Elander R. P. Industrial production of beta-lactam antibiotics. Appl. Microbiol. Biotechnol., 61 (5-6), 385–392 (2003). DOI: 10.1007/s00253-003-1274-y
- Mateo C., Abian O., Grazu V., et al. Recent Advances in the Industrial Enzymatic Synthesis of Semi-Synthetic β-Lactam Antibiotics. Chem. Rev. Online, 2 (3), 207–218 (2005). DOI: 10.2174/1567203054065691
- Barber M. S., Giesecke U., Reichert A., Minas W. Industrial enzymatic production of cephalosporin-based beta-lactams. Biochem. Eng. Biotechnol., 88, 179–215 (2004). DOI: 10.1007/b99261
- DeModena J. A., Gutiérrez S., Velasco J., et al. The production of cephalosporin C by Acremonium chrysogenum is improved by the intracellular expression of a bacterial hemoglobin. Bio/Technology, 11 (8), 926–929 (1993). DOI: 10.1038/nbt0893-926
- Rodríguez-Sáiz M., De La Fuente J. L., Barredo J. L. Cephalosporin Production by Fungal Metabolic Engineering. In: Encyclopedia of Industrial Biotechnology: Bioprocess, Bioseparation, and Cell Technology. Wiley (2009). DOI: 10.1002/9780470054581.eib331
- Johnson D. H., Cunha B. A. Aztreonam. Med. Clin. North Am., 79 (4), 733–743 (1995). DOI: 10.1016/S0025-7125(16)30036-0
- Leanza W. J., Wildonger K. J., Miller T. W., Christensen B. G. N-Acetimidoyl- and N-formimidoylthienamycin derivatives: antipseudomonal beta-lactam antibiotics. Med. Chem., 22 (12), 1435–1436 (1979). DOI: 10.1021/jm00198a001
- Kahan F. M., Kropp H., Sundelof J. G., Birnbaum J. Thienamycin: development of imipenem-cilastatin. Antimicrob. Chemother., 12 (Suppl D), 1–35 (1983). DOI: 10.1093/jac/12.suppl_d.1
- Retsema J., Fu W. Macrolides: structures and microbial targets. Int. J. Antimicrob. Agents, 18 (Suppl 1), S3–S10 (2001). DOI: 10.1016/S0924-8579(01)00401-0
- Zhu Z. J., Krasnykh O., Pan D., Petukhova V., Yu G., Liu Y., Liu H., Hong S., Wang Y., Wan B., Liang W., Franzblau S. G. Structure-activity relationships of macrolides against Mycobacterium tuberculosis. Tuberculosis, 88 (Suppl 1), S49–S63 (2008). DOI: 10.1016/S1472-9792(08)70036-2
- Omura S. Macrolide Antibiotics. Chemistry, Biology and Practice. Academic Press, San Diego, CA, USA (2002).
- Jelić D., Antolović R. From Erythromycin to Azithromycin and New Potential Ribosome-Binding Antimicrobials. Antibiotics, 5 (3), 29 (2016). DOI: 10.3390/antibiotics5030029
- Garrod L. P. The erythromycin group of antibiotics. Br. Med. J., 2 (5036), 57–63 (1957). DOI: 10.1136/bmj.2.5036.57
- Fidaxomicin: Difimicin; Lipiarmycin; OPT 80; OPT-80; PAR 101; PAR-101. Drugs R&D, 10 (1), 37–45 (2010). DOI: 10.2165/11537730-000000000-00000
- Kirst H. A. Macrolide Antibiotics. In: Marinelli F., Genilloud O. (eds) Antimicrobials. Springer, Berlin, Heidelberg (2014). DOI: 10.1007/978-3-642-39968-8_11.
- Chopra I., Roberts M. Tetracycline antibiotics: mode of action, applications, molecular biology, and epidemiology of bacterial resistance. Mol. Biol. Rev., 65 (2), 232–260 (2001). DOI: 10.1128/MMBR.65.2.232-260.2001
- Sobin, B. A., Finlay, A. C., Kane, J. H. Terramycin, a new antibiotic. Science, 112(2907), 423 (1950). DOI: 10.1126/science.112.2907.423
- Goodman J. J. Fermentation and Mutational Development of the Tetracyclines. In: Hlavka J. J., Boothe J. H. (eds) The Tetracyclines. Handbook of Experimental Pharmacology, vol 78. Springer, Berlin, Heidelberg (1985). DOI: 10.1007/978-3-642-70304-1_2
- Vardanyan R. S., Hruby V. J. Antibiotics. In: Synthesis of Essential Drugs, pp. 425–498 (2006). DOI: 10.1016/B978-044452166-8/50032-7
- Fuoco D. Classification Framework and Chemical Biology of Tetracycline-Structure-Based Drugs. Antibiotics, 1 (1), 1–13 (2012). DOI: 10.3390/antibiotics1010001
- Zhanel G., Critchley I., Lin L. Y., Alvandi N. Microbiological Profile of Sarecycline, a Novel Targeted Spectrum Tetracycline for the Treatment of Acne Vulgaris. Agents Chemother., 63 (1), e01297-18 (2018). DOI: 10.1128/AAC.01297-18
- Ramachanderan R., Schaefer B. Tetracycline antibiotics. ChemTexts, 7, 18 (2021). DOI: 10.1007/s40828-021-00138-x
- Davies J. E. Aminoglycosides: ancient and modern. Antibiot., 59 (9), 529–532 (2006). DOI: 10.1038/ja.2006.73
- Kirst H. A., Marinelli F. Aminoglycoside Antibiotics. In: Marinelli F., Genilloud O. (eds) Antimicrobials. Springer, Berlin, Heidelberg (2014). DOI: 10.1007/978-3-642-39968-8_10
- Mahajan G. B., Balachandran L. Antibacterial agents from actinomycetes - a review. Biosci. (Elite Ed.), 4 (1), 240–253 (2012). DOI: 10.2741/373
- Bulik C. C., Nightingale C. H., Nicolau D. P. Aminoglycosides. In: Vinks A., Derendorf H., Mouton J. (eds) Fundamentals of Antimicrobial Pharmacokinetics and Pharmacodynamics. Springer, New York, NY (2014). DOI: 10.1007/978-0-387-75613-4_9.
- Dutton C. J., Haxell M. A., McArthur H. A. I., Wax R. G. (eds.) Peptide Antibiotics: Discovery, Modes of Action and Applications. Marcel Dekker (2002). DOI: 10.1201/9780203910801
- Jenssen H., Hamill P., Hancock R. E. Peptide antimicrobial agents. Microbiol. Rev., 19 (3), 491–511 (2006). DOI: 10.1128/CMR.00056-05
- Magana M., Pushpanathan M., Santos A. L., et al. The value of antimicrobial peptides in the age of resistance. Lancet Infect. Dis., 20 (9), e216–e230 (2020). DOI: 10.1016/S1473-3099(20)30327-3
- Van Epps H. L. René Dubos: unearthing antibiotics. J. Exp. Med., 203 (2), 259 (2006). DOI: 10.1084/jem.2032fta
- Bricas E., Fromageot C. Naturally occurring peptides. Adv. Protein Chem., 8, 1–125 (1953). DOI: 10.1016/S0065-3233(08)60091-1
- Satlin M. J., Jenkins S. G. Polymyxins. In: Infectious Diseases (4th Ed.), Cohen J., Powderly W. G., Opal S. M. (eds.), Elsevier, pp. 1285–1288.e2 (2017). DOI: 10.1016/B978-0-7020-6285-8.00151-9
- Eliopoulos G. M., Thauvin C., Gerson B., Moellering R. C. Jr. In vitro activity and mechanism of action of A21978C1, a novel cyclic lipopeptide antibiotic. Agents Chemother., 27 (3), 357–362 (1985). DOI: 10.1128/AAC.27.3.357
- Sauermann R., Rothenburger M., Graninger W., Joukhadar C. Daptomycin: a review 4 years after first approval. Pharmacology, 81 (2), 79–91 (2008). DOI: 10.1159/000109868
- Kahne D., Leimkuhler C., Lu W., Walsh C. Glycopeptide and lipoglycopeptide antibiotics. Rev., 105 (2), 425–448 (2005). DOI: 10.1021/cr030103a
- Allen N. E. From vancomycin to oritavancin: the discovery and development of a novel lipoglycopeptide antibiotic. Agents Med. Chem., 9, 23–47 (2010). DOI: 10.2174/187152110790886745
- Rossolini G. M., Arena F., Pollini S. Novel Infectious Diseases and Emerging Gram-Positive Multi-Resistant Pathogens in Hospital and Community Acquired Infections. In: Marinelli F., Genilloud O. (eds) Antimicrobials. Springer, Berlin, Heidelberg (2014). DOI: 10.1007/978-3-642-39968-8_2
- Van Bambeke F. Glycopeptides and glycodepsipeptides in clinical development: a comparative review of their antibacterial spectrum, pharmacokinetics and clinical efficacy. Opin. Investig. Drugs, 7 (8), 740–749 (2006).
- van der Beek C. P., Roels J. A. Penicillin production: biotechnology at its best. Antonie van Leeuwenhoek, 50 (5-6), 625–639 (1984). DOI: 10.1007/BF02386230
- Hook D. J. Production of antibiotics by fermentation. In: Ratledge C., Kristiansen B. (eds) Basic Biotechnology. Cambridge University Press, pp. 433–456 (2006). DOI: 10.1017/CBO9780511802409.020
- Najafpour G. D. Industrial Microbiology. In: Biochemical Engineering and Biotechnology, pp. 1–13 (2007). DOI: 10.1016/B978-044452845-2/50001-X
- Моисеев Д. В., Лукашов Р. И., Веремчук О. А., Моисеева А. М. Фармацевтическая биотехнология: пособие. Витебск: ВГМУ (2019).
- Smith J. E. Concepts of Industrial Antibiotic Production. In: Alani D. I., Moo-Young M. (eds) Perspectives in Biotechnology and Applied Microbiology. Springer, Dordrecht (1986). DOI: 10.1007/978-94-009-4321-6_9
- Fayerman J. New Developments in Gene Cloning in Antibiotic Producing Microorganisms. Biotechnol., 4, 786–789 (1986). DOI: 10.1038/nbt0986-786
- Newbert R. W., Barton B., Greaves P., Harper J., Turner G. Analysis of a commercially improved Penicillium chrysogenum strain series: involvement of recombinogenic regions in amplification and deletion of the penicillin biosynthesis gene cluster. Ind. Microbiol. Biotechnol., 19 (1), 18–27 (1997). DOI: 10.1038/sj.jim.2900411
- Dahlmann T. A., Böhm J., Becker K., Kück U. Sexual recombination as a tool for engineering industrial Penicillium chrysogenum strains. Genet., 61 (4), 679–683 (2015). DOI: 10.1007/s00294-015-0497-7
- Bibb M. J. Regulation of secondary metabolism in streptomycetes. Opin. Microbiol., 8 (2), 208–215 (2005). DOI: 10.1016/j.mib.2005.02.016
- Begunova A. V., Rozhkova I. V., Shirshova T. I., Glazunova O. A., Fedorova T. V. Optimization of Cultivation Conditions for the Lactobacillus reuteri LR1 Strain to Improve the Biosynthesis of Bacteriocin-Like Substances. Biochem. Microbiol., 56, 920–929 (2020). DOI: 10.1134/S0003683820090033
- Bisht D., Iqbal Z. Lyophilization - Process and Optimization for Pharmaceuticals. J. Drug Regul. Aff., 3 (1), 30–40 (2018). DOI: 10.22270/ijdra.v3i1.156
- Просеков А. Ю., Кригер О. В., Дышлюк Л. С., Асякина Л. К. Промышленное производство биологически активных веществ: учебное пособие. Кемерово: КемГУ (2020).
- Mani I. Microbial Production of Vitamins. In: Singh V., Singh A., Bhargava P., Joshi M., Joshi C. (eds) Engineering of Microbial Biosynthetic Pathways. Springer, Singapore (2020). DOI: 10.1007/978-981-15-2604-6_9.
- You J., Pan X., Yang C., Du Y., Osire T., Yang T., Zhang X., Xu M., Xu G., Rao Z. Microbial production of riboflavin: Biotechnological advances and perspectives. Eng., 68, 46–58 (2021). DOI: 10.1016/j.ymben.2021.08.009.
- Averianova L. A., Balabanova L. A., Son O. M., Podvolotskaya A. B., Tekutyeva L. A. Production of Vitamin B₂ (Riboflavin) by Microorganisms: An Overview. Bioeng. Biotechnol., 8, 570828 (2020). DOI: 10.3389/fbioe.2020.570828
- Yu S., Zheng B., Chen Z., Huo Y. X. Metabolic engineering of Corynebacterium glutamicum for producing branched chain amino acids. Cell Fact., 20 (1), 230 (2021). DOI: 10.1186/s12934-021-01721-0.
- Martens J. H., Barg H., Warren M. J., Jahn D. Microbial production of vitamin B₁₂. Microbiol. Biotechnol., 58 (3), 275–285 (2002). DOI: 10.1007/s00253-001-0902-7
- Yuan P., Cui S., Li J., Du G., Chen J., Liu L. Microbial Production of Vitamins. In: Liu L., Chen J. (eds) Systems and Synthetic Biotechnology for Production of Nutraceuticals. Springer, Singapore (2019). DOI: 10.1007/978-981-15-0446-4_7.
- Leonardi R., Jackowski S. Biosynthesis of Pantothenic Acid and Coenzyme A. EcoSal Plus, 2 (2), 10.1128/ecosalplus.3.6.3.4 (2007). DOI: 10.1128/ecosalplus.3.6.3.4.
- Barreiro C., Barredo J. L. Carotenoids Production: A Healthy and Profitable Industry. In: Barreiro C., Barredo J. L. (eds) Microbial Carotenoids. Methods in Molecular Biology, 1852. Humana Press, New York, NY (2018). DOI: 10.1007/978-1-4939-8742-9_2.
- Agostoni C., Berni Canani R., Fairweather-Tait S., Heinonen M., Korhonen H., La Vieille S., Marchelli R., Martin A., Naska A., Neuhäuser-Berthold M., Nowicka G., Sanz Y., Siani A., Sjödin A., Stern M., Strain S. (J.J.), Tetens I., Tomé D., Turck D., Verhagen H. Scientific Opinion on the safety of vitamin D-enriched UV-treated baker's yeast. EFSA J., 12 (1), 3520 (2014). DOI: 10.2903/j.efsa.2014.3520.
- Ilczuk Z. Studies on citric acid synthesis. 3. The synthesis of vitamins B by strains of Aspergillus niger of different acid production activity. Acta Microbiol. Pol., 14 (3), 337–339 (1965).
- EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP); Bampidis V, Azimonti G, Bastos ML, Christensen H, Dusemund B, Durjava MF, Kouba M, López-Alonso M, López Puente S, Marcon F, Mayo B, Pechová A, Petkova M, Ramos F, Sanz Y, Villa RE, Woutersen R, Brantom PG, Cocconcelli PS, Glandorf B, Herman L, Maradona MP, Saarela M, Svensson K, Tosti L, Galobart J, Manini P, Pettenati E, Pizzo F, Tarrés-Call J, Anguita M. Safety and efficacy of the feed additive consisting of Vitamin B₂/Riboflavin produced by Eremothecium ashbyi CCTCCM 2019833 for all animal species (Hubei Guangji Pharmaceutical Co., Ltd). EFSA J., 19 (3), e06462 (2021). DOI: 10.2903/j.efsa.2021.6462
- Kogan L. M., Obol'nikova E. A., Luka V. T., Vetsozola A. O., Samokhvalov G. I. Ubikhinon-9 i érgosterin iz drozhzheĭ Candida paralipolytica [Ubiquinone-9 and ergosterol from Candida paralipolytica yeasts]. Biokhim. Mikrobiol., 21 (1), 78–79 (1985).
- Choudhari S., Singhal R. Media optimization for the production of beta-carotene by Blakeslea trispora: a statistical approach. Technol., 99 (4), 722–730 (2008). DOI: 10.1016/j.biortech.2007.01.044.
- Загоскина Н. В., Назаренко Л. В., Калашникова Е. А., Живухина Е. А. Биотехнология. Москва: Оникс (2009).
- Del Mondo A., Smerilli A., Sané E., Sansone C., Brunet C. Challenging microalgal vitamins for human health. Cell Fact., 19 (1), 201 (2020). DOI: 10.1186/s12934-020-01459-1
- Croft M. T., Warren M. J., Smith A. G. Algae need their vitamins. Cell, 5 (8), 1175–1183 (2006). DOI: 10.1128/EC.00097-06
- Becker E. W. Micro-algae as a source of protein. Biotechnol. Adv., 25 (2), 207–210 (2007). DOI: 10.1016/j.biotechadv.2006.11.002.
- Vicente A. R., Manganaris G. A., Sozzi G. O., Crisosto C. H. Nutritional Quality of Fruits and Vegetables. In: Postharvest Handling, pp. 57–106 (2009). DOI: 10.1016/B978-0-12-374112-7.00005-6
- Биотехнология: учебник для студентов высших учебных заведений, обучающихся по сельскохозяйственным, естественнонаучным, педагогическим специальностям и магистерским программам / [И. В. Тихонов и др.]; под ред. Е. С. Воронина. — Санкт-Петербург: ГИОРД, 2008. — 703 с.; ISBN 978-5-98879-072-3.
- Слюняев В.П. Основы биотехнологии. Основы промышленной биотехнологии: учебное пособие для бакалавров и магистров направлений 240100 "Химическая технология" и 241000 "Энерго- и ресурсосберегающие процессы в химической технологии, нефтехимии и биотехнологии" Санкт-Петербург: СПбЛГТУ, 2012
- Тенцова А. И. Микробиологический синтез стероидов. М.: Медицина (2003). С. 112–148.
- Надырова А.И., Коснырев А.С., Ульянова В.В., Дудкина Е.В., Вершинина В.И., Ильинская О.Н. Эффективность экспрессионных систем на основе Escherichia coli и Bacillus subtilis для получения мутантов рибонуклеазы биназы // Молекулярная биология. - 2023. - Т. 57. - №5. - C. 807-818. doi: 10.31857/S0026898423050154
- Itakura K., Hirose T., Crea R., et al. Expression in Escherichia coli of a chemically synthesized gene for the hormone somatostatin. Science, 198 (4321), 1056–1063 (1977). DOI: 10.1126/science.412251
- Goeddel D. V., Kleid D. G., Bolivar F., et al. Expression in Escherichia coli of chemically synthesized genes for human insulin. Natl. Acad. Sci. U.S.A., 76 (1), 106–110 (1979). DOI: 10.1073/pnas.76.1.106
- Sereikaite J., Statkute A., Morkunas M., Radzevicius K., Borromeo V., Secchi C., Bumelis V. A. Production of recombinant mink growth hormone in E. coli. Microbiol. Biotechnol., 74 (2), 316–323 (2007). DOI: 10.1007/s00253-006-0673-2.
- Donova M. V., Egorova O. V. Microbial steroid transformations: Current state and prospects. Microbiol. Biotechnol., 94 (6), 1423–1447 (2012). DOI: 10.1007/s00253-012-4078-0
- Donova, M.V. Transformation of steroids by actinobacteria: A review. Appl Biochem Microbiol 43, 1–14 (2007). DOI: 10.1134/S0003683807010012
- Mahato S. B., Mukherjee A. Microbial transformation of testosterone by Aspergillus fumigatus. Steroid Biochem., 21 (3), 341–342 (1984). DOI: 10.1016/0022-4731(84)90289-9.
- Ríos L. O. L., Luengo J. M., Fernández-Cañón J. M. Steroid 11-Alpha-Hydroxylation by the Fungi Aspergillus nidulans and Aspergillus ochraceus. Methods Mol. Biol., 1645, 271–287 (2017). DOI: 10.1007/978-1-4939-7183-1_19.
- Lenasi H., Breskvar K. Specific interactions of steroids, arylhydrocarbons and flavonoids with progesterone receptors from the cytosol of the fungus Rhizopus nigricans. Steroid Biochem. Mol. Biol., 91 (4-5), 273–284 (2004). DOI: 10.1016/j.jsbmb.2004.05.003
- Warner S. A., Sovocool G. W., Domnas A. J. Ergosterol, the unusual dominant sterol of the pythiaceous fungus Zoophagus insidians. Phytochemistry, 21 (8), 2135–2136 (1982). DOI: 10.1016/0031-9422(82)83069-0.
- Østergaard S., Olsson L., Nielsen J. Metabolic engineering of Saccharomyces cerevisiae. Mol. Biol. Rev., 64 (1), 34–50 (2000). DOI: 10.1128/MMBR.64.1.34-50.2000.
- Villena G. K., Kitazono A. A., Hernández-Macedo M. L. Bioengineering Fungi and Yeast for the Production of Enzymes, Metabolites, and Value-Added Compounds. In: Hesham A. L., Upadhyay R., Sharma G., Manoharachary C., Gupta V. (eds) Fungal Biotechnology and Bioengineering. Fungal Biology. Springer, Cham (2020). DOI: 10.1007/978-3-030-41870-0_9.
- Wu N., Wu X., Zhang M., Zhang C., Xu Q. Metabolic engineering of Aspergillus niger for accelerated malic acid biosynthesis by improving NADPH availability. J., 19 (5), e2400014 (2024). DOI: 10.1002/biot.202400014.
- Bennett J.W., Lasure L.L. More Gene Manipulations in Fungi. 2nd ed. Academic Press, 1991.
- Ward O. P. Production of recombinant proteins by filamentous fungi. Adv., 30 (5), 1119–1139 (2012). DOI: 10.1016/j.biotechadv.2011.09.012.
- Nielsen J., Keasling J. D. Engineering Cellular Metabolism. Cell, 164 (6), 1185–1197 (2016). DOI: 10.1016/j.cell.2016.02.004
- Bittencourt Fagundes M., Wagner R. Sterols Biosynthesis in Algae. IntechOpen (2021). DOI: 10.5772/intechopen.96719.
- Tang H. F., Yi Y. H., Yao X. S., Xu Q. Z., Zhang S. Y., Lin H. W. Bioactive steroids from the brown alga Sargassum carpophyllum. Asian Nat. Prod. Res., 4 (2), 95–101 (2002). DOI: 10.1080/10286020290027362.
- Stirk W. A., Van Staden J. Plant Growth Regulators in Seaweeds. In: Sea Plants, pp. 125–159 (2014). DOI: 10.1016/B978-0-12-408062-1.00005-6.
Лицензия
Copyright (c) 2025 Владимир Самойленко, Ольга Сазонова, Анна Иванова, Анастасия Ветрова (Автор)

Это произведение доступно по лицензии Creative Commons «Attribution-NonCommercial» («Атрибуция — Некоммерческое использование») 4.0 Всемирная.


